
| A. | 卤代烃在NaOH的醇溶液中共热均能发生消去反应生成烯烃 | |
| B. | 凡是能发生银镜反应的物质都属于醛类 | |
| C. | 能与FeCl3溶液作用显紫色的有机物一般含有酚羟基 | |
| D. | 酯类水解均能生成含相同碳原子数的羧酸和醇 |
分析 A.含1个C的卤代烃及与卤素原子相连C的邻位C上没有H,不能发生消去反应;
B.含-CHO的有机物可发生银镜反应;
C.含酚-OH的有机物能与氯化铁发生显色反应;
D.同碳的羧酸与醇生成的酯水解时生成含相同碳原子数的羧酸和醇.
解答 解:A.含1个C的卤代烃及与卤素原子相连C的邻位C上没有H,不能发生消去反应,符合与卤素原子相连C的邻位C上有H的可在NaOH的醇溶液中共热发生消去反应生成烯烃,故A错误;
B.含-CHO的有机物可发生银镜反应,如醛、甲酸、甲酸某酯、葡萄糖等,故B错误;
C.含酚-OH的有机物能与氯化铁发生显色反应,则能与FeCl3溶液作用显紫色的有机物一般含有酚羟基,故C正确;
D.同碳的羧酸与醇生成的酯水解时生成含相同碳原子数的羧酸和醇,如丙酸乙酯不能,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的结构、官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意有机反应的特点,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 化学方程式或结论 |
| 金属Na长时间放置在空气中 | 银白色的金属光泽消失,迅速变暗,有水珠生成,最终生成白色的粉末 | ①4Na+O2═2Na2O Na2O+H2O═2NaOH 2Na+2H2O═2NaOH+H2↑ 2NaOH+CO2═Na2CO3+H2O |
| 将一块Na置于石棉网上,点燃酒精灯加热 | 钠先熔成小球,剧烈燃烧并发出黄色的火焰,生成②淡黄色色的粉末 | 2Na+O2 ═Na2O2 |
| 往上述生成的 Na2O2上滴加蒸馏水 | 生成的气体能使带火星的木条复燃 | 该气体为③O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
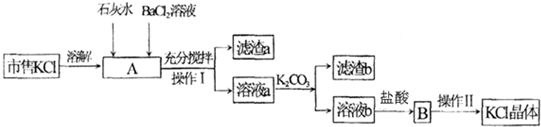
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C->D2->A+>B2+ | B. | B2+>A+>C->D2- | C. | B2+>A+>D2->C- | D. | D2->C->A+>B2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直接排放工业废气 | B. | 改进汽车尾气净化技术 | ||
| C. | 采用焚烧方法处理垃圾 | D. | 过度开采和使用化石燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O、S、Na的原子半径依次增大 | B. | LiOH、KOH、CsOH的碱性依次减弱 | ||
| C. | H2CO3的酸性比H3BO3的酸性弱 | D. | Cl-、Br-、I-的还原性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层电子数呈周期性变化 | B. | 元素的相对原子质量逐渐增大 | ||
| C. | 核电荷数逐渐增大 | D. | 核外电子排布呈周期性变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com