
【题目】化合物X是一种黄酮类化合物的中间体,其结构简式如图所示。下列有关化合物X的说法正确的是( )
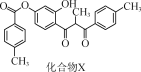
A.分子中所有碳原子共平面
B.分子中存在1个手性碳原子
C.化合物X不能使酸性KMnO4溶液褪色
D.1 mol化合物X最多可与12 mol H2发生加成反应
【答案】B
【解析】
A.由X的结构可知,其分子中的与一个甲基相连,并同时与两个羰基相连的C原子,其形成的是4条单键,由于这4条单键的键角约为109°28′,所以该C原子至多能和与其相连的C原子中的两个在同一平面内,因此该有机物中的所有碳原子不可能在同一平面内,A项错误;
B.手性碳是指连接4个不同原子或原子团的碳原子,由化合物X的结构可知,其分子中存在1个手性碳原子,如图, ,B项正确;
,B项正确;
C.由X的结构可知,其含有酚羟基,酚羟基易被氧化,因此该有机物可以使酸性高锰酸钾溶液褪色,C项错误;
D.由X的结构可知,该有机物中含有3个苯环可以与9个H2加成,另外含有两个酮羰基,也可与2个H2加成,因此1mol该有机物至多能与11molH2加成,D项错误;
答案选B。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)已知两种同素异形体A、B的热化学方程式为:A(s)+O2(g)═CO2(g)△H=﹣393.51 kJ·mol-1;B(s)+O2(g)═CO2(g)△H=﹣395.41 kJ·mol-1则两种同素异形体中较稳定的是(填“A”或“B”)______。
(2)已知化学反应N2+3H2![]() 2NH3的能量变化如图所示。
2NH3的能量变化如图所示。

①1 mol N和3 mol H生成1 mol NH3(g)是_______能量的过程(填“吸收”或“释放”)。由![]() mol N2(g)和
mol N2(g)和![]() mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)___________ kJ能量。(用图中字母表示,②同)
mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)___________ kJ能量。(用图中字母表示,②同)
②![]() mol N2(g)和
mol N2(g)和![]() mol H2(g)反应生成1 mol NH3(l)的△H = _______________。
mol H2(g)反应生成1 mol NH3(l)的△H = _______________。
(3)工业上用H2和Cl2反应制HCl,各键能为:H﹣H:436 kJ·mol-1,Cl﹣Cl:243 kJ·mol-1,H﹣Cl:431 kJ·mol-1。该反应的热化学方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸氯喹(C18H32ClN3O8P2)是当前治疗冠状病毒的药物之一,而碳、氮、氯、磷等是其重要的组成元素。完成下列填空:
(1)碳原子核外有__个轨道;氯原子最外层电子的轨道表示式是__。
(2)属于同主族的两种元素,非金属性大小的关系是__(用元素符号表示)。
(3)已知磷酸是弱电解质,它的分子式为H3PO4。其酸式盐Na2HPO4的电离方程式是__。经测定Na2HPO4的水溶液呈弱碱性,请用学过的化学知识进行解释:__。
(4)常温下,在CH3COONa溶液中加入一定量的HCl,使其pH=7,则c(Cl-)_c(CH3COOH)(填“<”、“>”、“=”)。
(5)向2.0L恒容的密闭容器中充入1.0molPCl5,发生如下反应:PCl5(s)PCl3(g)+C12(g)-124kJ。控制体系温度不变,反应过程中测定的部分数据见下表:
时间/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
①该条件下平衡常数的表达式为__;前50s内Cl2的反应速率为__。
②要提高上述反应中反应物的转化率,可采取的措施有__、__(任写两点)。
向上述达到平衡③的反应体系中,再加入0.02molPCl3、0.02molC12,则平衡__。移动(选填“正向”、“逆向”、“不”),平衡常数__(选填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类共同关注的重要问题。页岩气是从页岩层中开采出来的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g)=CO(g)+3H2(g) △H1
已知:①CH4、H2、CO的燃烧热(△H)分别为-a kJmol-1、-b kJmol-1、-c kJmol-1;
②H2O(l)=H2O(g);△H=+d kJmol-1
则△H1=____(用含字母a、b、c、d的代数式表示)kJmol-1。
(2)用合成气生成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如表所示:
CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如表所示:

t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①△H2____(填“>”“<”或“ = ”)0。
②下列说法正确的是____(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
③03min内用CH3OH表示的反应速率v(CH3OH)=____mol L-1·min-1。
④200℃时,该反应的平衡常数K=__。向上述200℃达到平衡的恒容密闭容器中再加入2mol CO、2mol H2、2mol CH3OH,保持温度不变,则化学平衡___(填“正向”、“逆向”或“不”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:
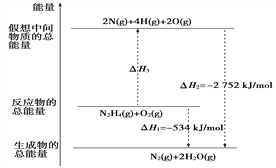
A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)某种粒子有1个原子核,核中有17个质子,20个中子,核外有18个电子,该粒子的化学符号是______________。
(2)现有下列物质:①H2 ②Na2O2 ③NaOH ④H2O2 ⑤CaCl2 ⑥NH4NO3 ⑦H2S。只由离子键构成的物质是_________;只由极性共价键构成的物质是_____;由极性键和非极性键构成的物质是_______;由离子键和极性键构成的物质是_______。(填序号)。
(3)写出下列物质的电子式:CaF2:______________CO2:______________ NH4Cl:________________。
(4) 用电子式表示下列化合物的形成过程:H2S:__________________________________;MgCl2:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:邻苯二甲酸(H2A)的Ka1=1.1×10-3,Ka2=3.9×10-6。室温下,用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1邻苯二甲酸氢钾(KHA)溶液。下列说法正确的是( )
A.0.1 mol·L-1 KHA溶液中:c(K+)>c(HA-)+2c(A2-)
B.加入NaOH溶液至pH=8时:c(K+)>c(A2-)>c(HA-)>c(H2A)
C.加入20 mL NaOH溶液时:c(OH-)+c(A2-)=c(Na+)+c(H+)+c(H2A)
D.在滴定过程中,水的电离程度一直减小
查看答案和解析>>
科目:高中化学 来源: 题型:
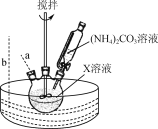
【题目】Co3O4(Co为+2和+3价)可应用于磁性材料等领域。实验室利用乙酸钴晶体[Co(CH3COO)2·4H2O]制备Co3O4的实验步骤如下:
Ⅰ. 将乙酸钴晶体配成溶液X,缓慢滴加(NH4)2CO3溶液,30 ℃水浴一段时间;
Ⅱ. 将混合液高压密封加热到160 ℃,得到含碱式碳酸钴晶体[2CoCO3·3Co(OH)2·H2O]的浊液;
Ⅲ. 制备碱式碳酸钴晶体;
Ⅳ. 将碱式碳酸钴晶体在空气中煅烧得Co3O4产品。
已知:碱式碳酸钴晶体不溶于冷水和乙醇,可溶于温水,常压下高于30 ℃开始分解。
(1) 乙酸钻晶体中钴含量可用配位滴定法测定,下列说法正确的是________(填字母)。
a. 滴定前,锥形瓶和滴定管均须用标准溶液润洗
b. 读数前,需排除滴定管尖嘴处的气泡
c. 滴定时,眼睛注视锥形瓶中颜色变化
(2) “步骤Ⅰ”30 ℃水浴的装置如右图所示,温度计应置于________(填“a”或“b”)处。
(3) “步骤Ⅱ”采用高压密封加热的目的是________。
(4) “步骤Ⅳ”中,在实验室煅烧碱式碳酸钴晶体所需的仪器除酒精灯、三脚架以外,还需要的硅酸盐质仪器有____________,煅烧时发生反应的化学方程式为________。
(5) “步骤Ⅲ”中,设计由“步骤Ⅱ”的浊液制备碱式碳酸钴晶体的实验方案:________________________。(实验须使用的试剂:蒸馏水、乙醇)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL 0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是
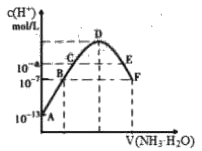
A.NaHB溶液可能为酸性,也可能为碱性
B.A、B、 C三点溶液的pH是逐渐减小,D、E、F三点溶液的pH是逐渐增大
C.B点溶液c(NH4+)=2c(B2-)
D.E溶液中离子浓度大小关系:c(NH4 +)> c(B2-)> c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com