
 .
.
分析 (1)装置Ⅰ为甲烷燃料电池,燃料在负极发生氧化反应,生成二氧化碳能够与KOH反应,导致溶液pH减小,氧气在正极发生还原反应,生成氢氧根离子;
(2)根据图知,Y是正极,b是阳极,用惰性电极电解饱和食盐水时,阴极上氢离子放电生成氢气,同时生成了氢氧根离子,溶液滴有酚酞的溶液显示红色;
(3)铜的电解精炼中,粗铜接阳极,因为阳极上有比铜活泼的金属放电,导致铜离子浓度减小;
(4)装置为电镀装置,铜棒增重2.16g,为Ag的质量,据此计算电子转移.
解答 解:(1)装置Ⅰ为甲烷燃料电池,燃料在负极发生氧化反应,生成二氧化碳能够与KOH反应,导致溶液pH减小,在碱性环境中,氧气在正极发生还原反应,生成氢氧根离子,电极反应式为:O2+2H2O+4e-=4OH-,故答案为:负极;O2+2H2O+4e-=4OH-;减小;
(2)电解饱和食盐水得到氢气、氯气和氢氧化钠,阴极上氢离子放电生成氢气,同时电极附近生成氢氧化钠,所以溶液碱性增强,酚酞试液遇碱变红色,电极反应式为:2H++2e-=H2↑,氯气的电子式为 ,故答案为:2H++2e-=H2↑;
,故答案为:2H++2e-=H2↑; ;
;
(3)电镀法精炼铜时,粗铜为阳极,精铜为阴极,所以阳极材料是粗铜;阳极上失电子变成离子进入溶液,因作阳极的粗铜中的铜和比铜活泼的金属都失去电子进入溶液,阴极溶液中Cu2+得到电子沉积在阴极上,所以,为阳极a电极连接粗铜,电解一段时间后,溶液中铜离子浓度在减小,
故答案为:粗铜;减小;
(4)生成n(Ag)=$\frac{2.16g}{108g/mol}$=0.02mol,转移电子0.02mol,故答案为:0.02mol.
点评 本题考查了燃料电池和电解池的相关知识,转移电子守恒的应用,题目难度中等.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:选择题
| A. | 生石灰、白磷、胆矾、纯碱分别属于氧化物、单质、纯净物、盐 | |
| B. | 按树状分类法,物质可分为纯净物和化合物 | |
| C. | NaCl溶液、KClO3、BaSO4都是电解质 | |
| D. | 按分散质粒子的大小,可以把分散系分为溶液、胶体和浊液,其中胶体和溶液的本质区别在于胶体能发生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3+HCl═NH4Cl | B. | H2S+Na2S═2NaHS | ||
| C. | 2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2 | D. | CO2+NaOH═NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能电离出H+的化合物叫做酸 | |
| B. | 实验测得1mol某气体体积为22.4L,测定条件一定是标准状况 | |
| C. | 将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体 | |
| D. | 碱性氧化物一定是金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
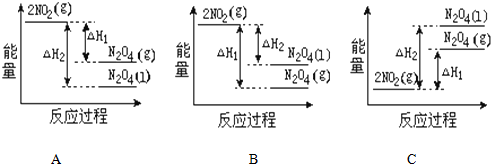
 (1)1.00g CH4完全燃烧生成液态水和CO2,放出55.6kJ热量,写出表示CH4的燃烧热的热化学方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ•mol-1.
(1)1.00g CH4完全燃烧生成液态水和CO2,放出55.6kJ热量,写出表示CH4的燃烧热的热化学方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液进行酸化 | |
| B. | 实验室配制FeCl3溶液时,先将FeCl3溶于浓盐酸再加水稀释 | |
| C. | 从海带灰中提取碘时,为了使I-既能完全转化为I2,又对环境无影响,可选H2O2作氧化剂 | |
| D. | 制备硫酸亚铁铵晶体,在蒸发皿中蒸发浓缩溶液时,不能将溶液全部蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠溶于水中 | B. | NH3(g)与HCl(g)反应生成NH4Cl(s) | ||
| C. | 干冰(CO2)的升华 | D. | CaCO3(s)分解为CaO(s)和CO2(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com