
【题目】下列说法不正确的是
A. 某外围电子排布为4d15s2基态原子,该元素位于周期表中第五周期第ⅢB族
B. 在元素周期表中,s区,d区和ds区的元素都是金属元素
C. 当碳原子的核外电子排布由![]() 转变为
转变为![]() 时,释放能量,由激发态转化成基态
时,释放能量,由激发态转化成基态
D. 非金属元素形成的共价化合物中,原子的最外层电子数不一定是2或8
【答案】B
【解析】
某外围电子排布为4d15s2基态原子,价层电子数为3,位于第五周期,该元素位于周期表中第5周期第ⅢB族,故A正确;B.s区的H为非金属元素,d区和ds区的元素包括副族和第VIII族元素,副族和第VIII族元素全部是金属元素,故B错误;C.碳原子的核外电子排布为:1s22s22p2,该原子处于基态,当核外电子排布为1s22s12p3,该原子处于激发态,所以由碳原子的核外电子排布由![]() 转变为
转变为![]() 的过程为由激发态变为基态,故C正确;D.非金属元素形成的共价化合物中,原子的最外层电子数除了2或8外,像一氧化碳、一氧化氮、二氧化硫等均不符合2或8电子结构,故D正确,答案为B。
的过程为由激发态变为基态,故C正确;D.非金属元素形成的共价化合物中,原子的最外层电子数除了2或8外,像一氧化碳、一氧化氮、二氧化硫等均不符合2或8电子结构,故D正确,答案为B。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ、常温下,将0.1 mo1/L CH3COONa和0.05 mo1/L HCl等体积混合溶液呈酸性(忽略混合过程中体积变化)。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表达_______________________、_______________________、______________________。
(2)该溶液中,浓度为0.05 mol/L的粒子是_____(填离子符号)。c(Cl-)、c(CH3COO-)、c(CH3COOH)三种离子浓度由大到小的关系是__________________。
Ⅱ、现有浓度为0.1 mol/L的四种电解质溶液①Na2CO3;②NaHCO3;③NaAlO2;④CH3COONa。已知:CO2 + 3H2O + 2A1O2- = 2Al(OH)3↓ + CO32-
(1)这四种溶液的pH由小到大的顺序是:______________(填编号);
(2)在上述四种溶液中分别加入AlCl3溶液,能产生大量无色无味气体的是:________(填编号);
(3)将上述①、②、③、④四种溶液两两混合时,有一对溶液相互间能发生反应,写出该反应的离子方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化钡是一种使用广泛的化学试剂。某课外小组通过下列实验测定某试样中Ba(OH)2·nH2O的含量。
(1)称取3.50g试样溶于蒸馏水配成100mL溶液,从中取出10.0mL溶液于锥形瓶中,用0.100mol/LHCl溶液中和,共消耗盐酸20.0mL(杂质不与酸反应),求试样中氢氧化钡的物质的量____。
(2)另取5.25g试样加热至失去全部结晶水(杂质不分解),称得质量为3.09g,求Ba(OH)2·nH2O中的n值___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应时,既要考虑物质变化与能量变化,又要关注反应的快慢与限度。回答下列问题:
(1)NH3还原NO是重要的烟气脱硝技术,其反应过程与能量关系如下图所示。

①上图中因为改变了反应条件,反应的活化能b___________(填“>”“<”或“=”)a。
②脱硝反应的热化学方程式可表示为反应物→生成物△H=___________(用E1, E2的代数式表示)
③研究发现,一定条件下的脱硝反应过程可能如图所示,根据氧化还原反应中物质的作用,NO为剂____,脱硝总反应的化学方程式为:___________。
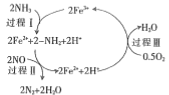
(2)一定温度下,将不同物质的量的H2O(g)和CO分别通入容积为1L的恒容密闭容器中,进行反应H2O(g)+CO(g)=CO2(g)+H2(g),得到如表所示的三组数据:
实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O(g) | CO(g) | CO(g) | H2(g) | |||
1 | 650 | 2.0 | 4.0 | 3.0 | 1.0 | 5 |
2 | 900 | 1.0 | 2.0 | 1.8 | 0.2 | 4 |
3 | 900 | a | b | c | d | t |
①实验2:4min
②650℃时,若在此容器中充入2.0molH2O(g)、1.0molCO(g)、1.0molCO2(g)和xmolH2(g),要使反应在开始时间向正反应方向进行,则x应满足的条件是___________。
③若a=2.0,b=1.0,则平衡时实验2中H2O(g)和实验3中CO(g)的转化率(α)的关系为α(H2O)___________(填“>”“<”或“=”)α(CO)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】山道年蒿中提取出一种具有明显抗癌活性的有机物X,其结构简式如下图所示。下列有关说法错误的是

A. 该物质的分子式为C10H16O2
B. 该物质不可能所有的碳原子共平面
C. 该物质的一氯代物共有7种
D. 该物质能发生加成、取代、氧化、消去、还原等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为﹣2价.如图所示为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是

A. 晶体中每个K+周围有8个O2﹣,每个O2﹣周围有8个K+
B. 晶体中与每个K+距离最近的K+有8个
C. 超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2﹣
D. 晶体中,0价氧与﹣2价氧的数目比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在工农业生产中应用广泛。
(1)基态硼原子的核外电子排布式为____________,基态硼原子有_______种不同能量的电子。
(2)BF3溶于水后,在一定条件下可转化为H3O+·[B(OH)F3]-,该物质中阳离子的空间构型为_____________,阴离子的中心原子轨道采用________杂化。
(3)与BH4-互为等电子体的分子是__________(写化学式)。
(4)EminBF4的熔点为12 ℃,在常温下为液体,由有机物阳离子[Emin]+和[BF4]-构成。该物质的晶体属于_________晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最活泼的金属元素、最活泼的非金属元素、常温下呈液态的金属(价电子排布为5d106s2)元素分别位于下面元素周期表中的( )
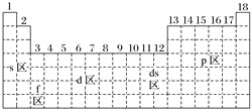
A. s区、p区、ds区 B. s区、p区、d区
C. f区、p区、ds区 D. s区、f区、ds区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝苯地平H是一种治疗高血压的药物;其一种合成路线如下:

已知:酯分子中的a-碳原子上的氢比较活泼,使酯与酯之间能发生缩合反应。
![]()
回答下列问题:
(1)B的化学名称为________.
(2)②的反应类型是________.
(3)D的结构简式为________.
(4)H的分子式为________.
(5)反应①的化学方程式为________.
(6)已知M与G互为同分异构体,M在一定条体下能发生银镜反应,核磁共振氢谱显示有4组峰,峰面积之比为1:1:2:4,写出M的一种可能的结构简式________.
(7)拉西地平 也是一种治疗高血压药物,设以乙醇和
也是一种治疗高血压药物,设以乙醇和 为原料制备拉西地平的合成路线(无机试剂任选)。________________________
为原料制备拉西地平的合成路线(无机试剂任选)。________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com