
 前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族.F是第四周期未成对电子最多的原子,G是目前使用量最多的金属.
前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族.F是第四周期未成对电子最多的原子,G是目前使用量最多的金属.分析 根据“A元素的质子数和质量数相等”推知A为H(氢);根据“B元素具有三个能级且所排电子数相同”推知B为C(碳);根据“D元素2p能级上电子数是2s能级的两倍”推知D为O(氧);根据“B、C、D原子序数依次增大”推知C为N(氮);根据“D和E相邻且同主族”推知E为S(硫);第四周期中Cr元素的未成对电子高达6个最多,故F为Cr(铬);根据“G是目前使用量最多的金属”推知G为Fe(铁).
(1)Cr的价电子排布式是保证3d能级和4s能级都处于半充满状态,更加稳定;第一电离能同一周期从左到右呈增大趋势,ⅡA族、Ⅴ族反常;
(2)计算CO32-中碳原子孤电子对数、价层电子对数,确定碳原子杂化方式、微粒的空间构型;
(3)铵盐属于离子化合物存在离子键也存在共价键;HCN分子中存在两条σ键和2条π键;NH3通过氢键形成“缔合”分子;
(4)根据均摊法计算晶胞中Fe、S原子数目,约成最简整数比既得化学式;计算晶胞质量,根据密度×体积=质量的公式,假设该晶胞的边长为a,代入数据得a,二者距离最近的S原子之间距离为晶胞边长的$\frac{\sqrt{2}}{2}$.
解答 解:根据“A元素的质子数和质量数相等”推知A为H(氢);根据“B元素具有三个能级且所排电子数相同”推知B为C(碳);根据“D元素2p能级上电子数是2s能级的两倍”推知D为O(氧);根据“B、C、D原子序数依次增大”推知C为N(氮);根据“D和E相邻且同主族”推知E为S(硫);第四周期中Cr元素的未成对电子高达6个最多,故F为Cr(铬);根据“G是目前使用量最多的金属”推知G为Fe(铁).
(1)Cr的价电子排布式是保证3d能级和4s能级都处于半充满状态,更加稳定,故Cr的价电子排布为3d54s1;
第一电离能同一周期从左到右呈增大趋势,ⅡA族、Ⅴ族反常,故的原动力N>O>C;
故答案为:3d54s1;N>O>C;
(2)CO32-中C原子孤电子对数=$\frac{4+2-2×3}{2}$=0,价层电子对数=3+0=3,故碳原子杂化方式为sp2杂化,空间构型为平面正三角形,
故答案为:sp2杂化;平面正三角形;
(3)铵盐属于离子化合物存在离子键也存在共价键,三种元素形成的铵盐可以是NH4NO3或者NH4NO2;
HCN中存在两条σ键和2条π键,二者之比为1:1;
NH3通过氢键形成“缔合”分子,导致相对分子质量增大,分子间作用力增强,分子间距离减小,导致密度反常增大,
故答案为:NH4NO3或者NH4NO2;1:1;NH3通过氢键形成“缔合”分子,导致相对分子质量增大,分子间作用力增强,分子间距离减小,导致密度反常增大;
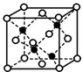
(4)黑球铁处于晶胞晶胞,晶胞中含有4个Fe原子,白球S处于顶点和面心,晶胞中含有S原子数目为6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,约成最简整数比既得化学式为FeS,
晶胞质量为4×$\frac{56+32}{{N}_{A}}$g,假设该晶胞的边长为a cm,则(a cm)3×ρ g/cm3=4×$\frac{56+32}{{N}_{A}}$g,则a=$\root{3}{\frac{352}{{ρ×N}_{A}}}$,距离最近的S原子之间距离为晶胞边长的$\frac{\sqrt{2}}{2}$,故S原子之间距离为$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{352}{{ρ×N}_{A}}}$ cm,
故答案为:FeS;$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{352}{{ρ×N}_{A}}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、电负性、分子结构与性质、氢键、晶胞计算等,是对物质结构主干知识的综合考查,注意同周期第一电离能异常情况,(5)中计算为易错点、难点,需要学生具备一定的数学计算能力.


 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题
| A. | 将金粉和铁粉混合 | B. | 将牛奶加入水中混合 | ||
| C. | 蒸发食盐水制取食盐晶体 | D. | 用漏斗、滤纸过滤除去水中的泥沙 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| B. | 含有AgCl和Agl固体的悬浊液:c(Ag+)>c(Cl-)>(I-) | |
| C. | 25℃时,NH4Cl溶液的KN大于100℃时NaCl溶液的KN | |
| D. | 1g氢气燃烧生成液态水,放出的热量为142.9kJ.故氢气燃烧热的热化学方程式可以表示为:H2(g)+$\frac{1}{2}$O2(g)=H2O(I)△H=-285.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$CuS | B. | 3Cu+8HO3(浓)=3Cu(NO3)2+2NO↑+4H2O | ||
| C. |  | D. | 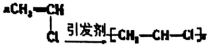 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 510 | 770 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
| A. | 甲组和乙组的实验中,盐酸均是过量的 | |
| B. | 盐酸的物质的量浓度为0.8 mol/L | |
| C. | 合金中镁铝的物质的量之比为1:1 | |
| D. | 丙组充分反应后铝的物质的量为0.01mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)=c(CH3COO-)+c(CH3COOH) | B. | c(H+)=c(CH3COO-)+c(OH-) | ||
| C. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | D. | c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
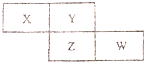 X、Y、Z、W四种短周期元素在周期表中的位置关系如图:
X、Y、Z、W四种短周期元素在周期表中的位置关系如图: .
.
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com