
| A. | m1>m2 | B. | m1<m2 | C. | m1≥m2 | D. | m1≤m2 |
科目:高中化学 来源: 题型:解答题
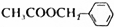 )是其中的一种,它可以从茉莉花香中提取,也可以用甲苯和乙醇为原料进行人工合成,一种合成路线如下:
)是其中的一种,它可以从茉莉花香中提取,也可以用甲苯和乙醇为原料进行人工合成,一种合成路线如下:
 .
. ,名称为苯甲醇.
,名称为苯甲醇.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C的生成速率与C的分解速率相等 | |
| B. | 单位时间内生成nmolA的同时生成3nmol的B | |
| C. | A,B,C三种物质的浓度相等 | |
| D. | A,B,C的物质的量之比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
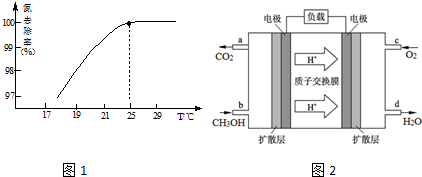
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2SO2+O2$\frac{\underline{\;500℃\;}}{V_{2}O_{5}}$2SO3△H=-196.6KJ•mol-1 | |
| B. | C(s)+O2(g)═CO2 (g)△H=+393.5KJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571kJ | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
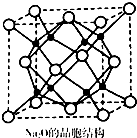 氮及其化合物与人类生产、生活息息相关.回答下列问题:
氮及其化合物与人类生产、生活息息相关.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只用溴水一种试剂可鉴别甲苯、乙烯、乙醇、四氯化碳四种物质 | |
| B. | 将乙醇加热到170℃可制得乙烯 | |
| C. | 用乙醇、冰醋酸及pH=0的硫酸加热可制乙酸乙酯 | |
| D. | 用酚酞可鉴别苯酚钠和乙醇钠两种溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com