
向AgCl饱和溶液中滴加足量NaBr溶液,产生淡黄色沉淀,再向溶液中滴加KI溶液,又产生黄色沉淀。有关下列说法正确的是( )
A.产生的淡黄色沉淀为AgI
B.产生的黄色沉淀为AgBr
C.由上述实验现象可说明溶解度S(AgBr)>S(AgI)>S(AgCl)
D.上述实验现象说明沉淀之间可相互转化
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
已知热化学方程式:
2H2O(l)===2H2(g)+O2(g) ΔH=571.6 kJ·mol-1
2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1
当1 g液态水变为气态水时,对其热量变化的下列描述:①放热;②吸热;③2.44 kJ;
④4.88 kJ;⑤88 kJ。其中正确的是( )
A.②和⑤ B.①和③ C.②和④ D.②和③
查看答案和解析>>
科目:高中化学 来源: 题型:
煤燃烧的反应热可通过以下两个途径来利用:
a.利用煤在充足的空气中直接燃烧产生的反应热;
b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为
a.C(s)+O2(g)====CO2(g) ΔH=E1 ①
b.C(s)+H2O(g)====CO(g)+H2(g) ΔH=E2 ②
H2(g)+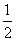 O2(g)====H2O(g) ΔH=E3 ③
O2(g)====H2O(g) ΔH=E3 ③
CO(g)+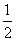 O2(g)====CO2(g) ΔH=E4 ④
O2(g)====CO2(g) ΔH=E4 ④
回答下列问题:
(1)与途径a相比途径b有较多的优点,即____________________________。
(2)上述四个热化学方程式中的反应__________________中ΔH>0。
(3)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是____________。
A.a比b多 B.a比b少 C.a与b在理论上相同
(4)根据能量守恒定律,E1、E2、E3、E4之间的关系为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在固定容积的密闭容器中,反应A(g)+3B(g) 2C
2C (g)达到平衡,测得平衡时A、B、C物质的量之比为1∶1∶2,若保持温度不变,以1∶1∶2的物质的量之比再充入A、B和C,下列判断正确的是( )
(g)达到平衡,测得平衡时A、B、C物质的量之比为1∶1∶2,若保持温度不变,以1∶1∶2的物质的量之比再充入A、B和C,下列判断正确的是( )
A.平衡不移动
B.平衡向逆反应方向移动
C.再次达到平衡时各物质的浓度都比原平衡时大
D.C的质量分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
光气(COCl2)在塑料、制革、制药 等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为____________________________;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(ΔH)分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1和
-283.0 kJ·mol-1,则生成1 m3(标准状况)CO所需热量为______________;
(3)COCl2的分解反应为COCl2(g)====Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10 min到14 min的COCl2浓度变化曲线未表示出):
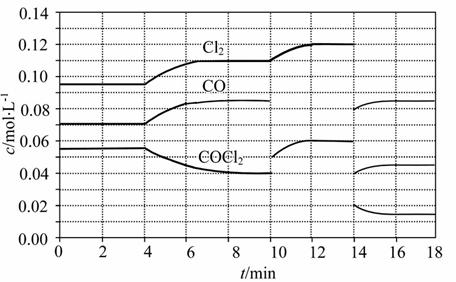
①计算反应在第8 min时的平衡常数K=__________;
②比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2)_____
T(8)(填“<”“>”或“=”);
③若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=________
___ mol·L-1;
④比较反应物COCl2在5 min~6 min和15 min~16 min时平均反应速率的大小:v(5~6)_____v(15~16)(填“<”“>”或“=”),原因是______________
_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某酸式盐NaHY的水溶液显碱性,下列叙述正确的是
( )
A.H2Y的电离方程式:H2Y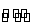 2H++Y2-
2H++Y2-
B.HY-的水解方程式:HY-+H2O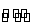 H3O++Y2-
H3O++Y2-
C.该酸式盐溶液中离子浓度关系:[Na+]>[HY-]>[OH-]>[H+]
D.该酸式盐溶液中离子浓度关系:[Na+]>[Y2-]>[HY-]>[OH-]>[H+]
查看答案和解析>>
科目:高中化学 来源: 题型:
已知一种[H+]=1×10-3 mol·L-1的某酸与一种[OH-]=1×10-3 mol·L-1的某碱等体积混合后溶液呈酸性,其原因可能是( )
A.稀的强碱与浓的强酸反应
B.等物质的量浓度的一元强酸和一元弱碱反应
C.浓的弱酸与稀的强碱溶液反应
D.生成一种强酸弱碱盐
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z、W为短周期元素,原子半径X:99 pm Y:154 pm Z:125 pm W:117 pm,X 、Y、 W位置如图所示(副族省略),X、Y、Z的最高价氧化物对应的水化物相互能反应,下列说法正确的是(双选)( )
| X | ||||
| Y | W |
A.元素Z处于周期表的阴影位置
B.非金属性:X>W
C.X与W形成化合物熔点很高,为离子化合物
D.Y、W的最高价氧化物对应的水化物能反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某酸性溶液中含有Ba2+、Fe3+,则下列能与上述离子共存的离子组是( )
|
| A. | CO32﹣、SO42﹣、NH4+、Na+ | B. | Cl﹣、SCN﹣、NO3﹣、Cu2+ |
|
| C. | Br﹣、I﹣、Mg2+、Na+ | D. | H+、Cl﹣、NO3﹣、Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com