
【题目】已知A,B,C,D,E、F六种元素的原子序数依次增大,其中A元素的原子半径在短周期元素中最小;B原子核外电子有6种不同的运动状态;D原子L层上有2对成对电子。E元素在地壳中含量居第二位,F 与E位于同一周期,且是该周期元素中电负性最大的元素。
根据以上信息回答下列问题:
(1)E元素可分别与D元素、F元素形成两种常见化合物,这两种化合物的熔沸点高低顺序为____________(用化学式表示),原因是_____________________。
(2)C的氢化物比下周期同族元素的氢化物沸点还要高,其原因是____________。
(3)1 mol B2A2分子中含σ键的数目是____________。
(4)图(Ⅰ)是B元素的单质晶体的一个晶胞,该晶胞中含有_____个原子,该晶体类型为________。
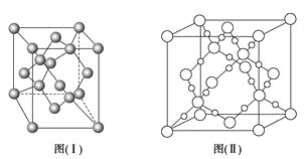
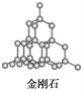
(5)E单质存在与金刚石结构类似的晶体,晶体中原子之间以_________相结合,其晶胞中共有8个原子,其中在面心位置贡献______个原子。
(6)BD2在高温高压下所形成的晶体其晶胞如图(Ⅱ)所示。该晶体的类型属于_______(填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子轨道的杂化类型为__________。
【答案】SiO2>SiCl4 二氧化硅为原子晶体,而SiCl4为分子晶体 NH3分子间形成氢键,同族其他元素氢化物分子间不能形成氢键 3NA(或1.806×1024) 8 原子晶体 共价键 3 原子 sp3杂化
【解析】
已知A,B,C,D,E、F六种元素的原子序数依次增大,其中A元素的原子半径在短周期元素中最小,则A为氢元素;B原子核外电子有6种不同的运动状态,核外电子数为6,则B为碳元素;D原子L层上有2对成对电子,则D外围电子排布为2s22p4,则D为氧元素。C的原子序数介于碳元素与氧元素之间,则C为氮元素;E元素在地壳中含量居第二位,则E为硅元素;F 与E位于同一周期,且是该周期元素中电负性最大的元素,F为氯元素。
由分析可知:A为氢元素、B为碳元素、C为氮元素、D为氧元素、E为硅元素、F为氯元素。
(1)E元素可分别与D元素、F元素形成两种常见化合物SiO2和SiCl4 ,这两种化合物的熔沸点高低顺序为SiO2>SiCl4 ,原因是二氧化硅为原子晶体,而SiCl4为分子晶体;
(2)C的氢化物NH3比下周期同族元素的氢化物PH3沸点还要高,其原因是NH3分子间形成氢键,同族其他元素氢化物分子间不能形成氢键。
(3)C2H2分子中含有1个C≡C叁键、2个C-H单键,叁键中含有1个σ键、2个π键,单键都是σ键,故1mol C2H2分子中含σ键的数目是3NA(或1.806×1024) ;
(4)由图(Ⅰ)中B元素的单质的晶胞结构示意图可知,该晶胞中4个C原子位于晶胞内部、6个C原子位于面心、8个C原子位于顶点上,故该晶胞中含有C原子数目=4+6×1/2+8×1/8=8;碳原子之间是以共价键结合形成空间网状结构,故该晶体类型为原子晶体。
(5)硅晶体和金刚石晶体都属于原子晶体,硅原子之间以共价键结合.在金刚石晶体的晶胞中,每个面心有一个碳原子,晶体硅有着类似结构,则面心位置贡献的原子为 6×1/2=3个;
(6)由CO2在高温高压下所形成的晶体的晶胞结构示意图可知.该晶体中相邻的原子间通过共价键形成空间网状结构晶体,故基属于原子晶体;该晶体中每个C原子形成4个C-O单键,故C原子轨道的杂化类型为sp3。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】色酮类化合物K具有抗菌、降血脂等生理活性,其合成路线如图:

已知:① +HCl(R代表烃基)
+HCl(R代表烃基)
②![]() +R’OH
+R’OH![]() +RCOOH(R、R’代表烃基)
+RCOOH(R、R’代表烃基)
③ (R、R1、R2、R3、R4代表烃基)
(R、R1、R2、R3、R4代表烃基)
(1)A的结构简式是__;根据系统命名法,F的名称是__。
(2)B→C所需试剂a是__;试剂b的结构简式是__。
(3)C与足量的NaOH反应的化学方程式为__。
(4)G与新制Cu(OH)2反应的化学方程式为__。
(5)已知:①2H![]() J+H2O;②J的核磁共振氢谱只有两组峰。
J+H2O;②J的核磁共振氢谱只有两组峰。
以E和J为原料合成K分为三步反应,写出有关化合物的结构简式:

E:__;J:__;中间产物2:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. ![]() 的一溴代物和
的一溴代物和![]() 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)
B. CH3CH=CHCH3分子中的四个碳原子在同一直线上
C. 按系统命名法,化合物 的名称是2,3,4-三甲基-2-乙基戊烷
的名称是2,3,4-三甲基-2-乙基戊烷
D. ![]() 与
与![]() 都是α-氨基酸且互为同系物
都是α-氨基酸且互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:

下列有关叙述正确的是( )
A. 贝诺酯分子中有三种含氧官能团
B. 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚
C. 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应
D. 贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CsCl晶体的密度为ρg·cm-3,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为acm,如图所示,则CsCl的相对分子质量可以表示为( )
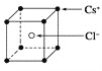
A. NA·a3·ρ B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为__________,该元素的符号是__________;
 (2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
(2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为____________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________________________________;
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. Cu2S(s)![]() Cu(s)
Cu(s)![]() CuCl2(s)
CuCl2(s)
B. SiO2(s)![]() H2SiO3(s)
H2SiO3(s)![]() Na2SiO3(aq)
Na2SiO3(aq)
C. Fe(s)![]() Fe2O3(s)
Fe2O3(s)![]() Fe2(SO4)3(aq)
Fe2(SO4)3(aq)
D. NaCl(aq)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(aq)
NaOH(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧法是测定有机化合物分子式的一种重要方法。0.05mol某烃完全燃烧后,测得生成的二氧化碳为5.6L(STP)、生成的水为5.4g。请通过计推导该烃的分子式,并写出它可能的结构简式及对应的名称。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向稀硫酸中逐滴加入氢氧化钡溶液过程中的电导率如图,下列说法不正确的是:

A.A点硫酸浓度最大
B.B点溶液中离子浓度小于A点
C.C点的导电率不为零是因为硫酸有剩余
D.D点溶液中的主要离子为Ba2+和OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com