
| A��N2H4��g��+2H2O2��l��= N2��g��+4H2O��l����H����817.63 kJ��mol��1 |
| B��N2H4��g��+2H2O2��l��= N2��g��+4H2O��g����H����641.63 kJ��mol��1 |
| C��N2H4��g��+2H2O2��l��= N2��g��+4H2O��l����H����641.63 kJ��mol��1 |
| D��N2H4��g��+2H2O2��l��= N2��g��+4H2O��g����H����817.63 kJ��mol��1 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

 BaCO3(s)+SO42��(aq)
BaCO3(s)+SO42��(aq)�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
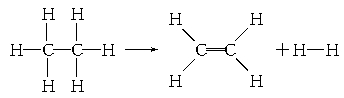
| A���÷�Ӧ�ų�251.2 kJ������ | B���÷�Ӧ����251.2 kJ������ |
| C���÷�Ӧ�ų�125.6 kJ������ | D���÷�Ӧ����125.6 kJ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

 O2(g)=H2O(l) ��H3= ��285.8 kJ?mol-1
O2(g)=H2O(l) ��H3= ��285.8 kJ?mol-1�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO(g)+H2O(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
CO(g)+H2O(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���| t���棩 | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
 2CO2��N2��Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��������崫������ò�ͬʱ���NO��COŨ�������
2CO2��N2��Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��������崫������ò�ͬʱ���NO��COŨ�������| ʱ��(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (mol/L) | 1.00��10��3 | 4.50��10��4 | 2.50��10��4 | 1.50��10��4 | 1.00��10��4 | 1.00��10��4 |
| c(CO) (mol/L) | 3.60��10��3 | 3.05��10��3 | 2.85��10��3 | 2.75��10��3 | 2.70��10��3 | 2.70��10��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��(c-a-b)kJ | B��(a+b-c)kJ |
| C��(2c-a-b)kJ | D��(2c-a-b)/2kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2HCl(g)����H����184.6kJ��mol��1��
2HCl(g)����H����184.6kJ��mol��1�� H2(g)��Cl2(g)�ġ�HΪ
H2(g)��Cl2(g)�ġ�HΪ| A����92.3 kJ��mol��1 | B����92.3 kJ��mol��1 |
| C����369.2 kJ��mol��1 | D����184.6 kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���÷�Ӧ��������ԭ�� |
| B��������£�Һ̬��ȼ������1molN2ʱ�ų�������Ϊ641.6kJ |
| C����(N2H4)������ֻ���ڼ��Թ��ۼ� |
| D���÷�Ӧ�ķ�Ӧ������������������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Q1��Q2��Q3 |
| B��0.5Q1��0.5Q2��1.5Q3 |
| C��0.5��Q1��Q2��Q3�� |
| D��0.5Q1��1.5Q2��0.5Q3 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com