
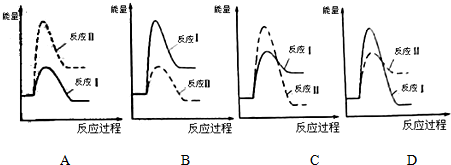
 Ba 2+(aq)+SO4 2-(aq)△H=+40KJ/mol.
Ba 2+(aq)+SO4 2-(aq)△H=+40KJ/mol. 分析 (1)反应速率越快,活化能越低;反应Ⅰ为吸热反应,反应物总能量小于生成物总能量,反应Ⅱ为放热反应,反应物总能量大于成物总能量;
(2)中和热的△H=-57.3kJ/mol,则①:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,
又知②:Ba 2+(aq)+2OH-(aq)+2H+(aq)+SO4 2-(aq)=BaSO4(s)+2H2O(l)△H=-154.6kJ/mol,
根据盖斯定律,①×2-②可得:Ba SO4 (s)  Ba 2+(aq)+SO4 2-(aq).
Ba 2+(aq)+SO4 2-(aq).
解答 解:(1)反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),反应速率越快,活化能越低,则说明Ⅰ的活化能<Ⅱ的活化能,
反应Ⅰ为吸热反应,反应物总能量小于生成物总能量,反应Ⅱ为放热反应,反应物总能量大于成物总能量,则A、D错误,Ⅰ的活化能<Ⅱ的活化能,则B错误、C正确,
故答案为:<;C;
(2)中和热的△H=-57.3kJ/mol,则①:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,
又知②:Ba 2+(aq)+2OH-(aq)+2H+(aq)+SO4 2-(aq)=BaSO4(s)+2H2O(l)△H=-154.6kJ/mol,
根据盖斯定律,①×2-②可得:Ba SO4 (s)  Ba 2+(aq)+SO4 2-(aq),△H=2×(-57.3kJ/mol)-(-154.6kJ/mol)=+40kJ/mol,
Ba 2+(aq)+SO4 2-(aq),△H=2×(-57.3kJ/mol)-(-154.6kJ/mol)=+40kJ/mol,
故答案为:Ba SO4 (s)  Ba 2+(aq)+SO4 2-(aq)△H=+40KJ/mol.
Ba 2+(aq)+SO4 2-(aq)△H=+40KJ/mol.
点评 本题考查化学反应能量变化图象、吸热反应与放热反应、热化学方程式书写,注意盖斯定律的理解与应用,题目难度中等.


科目:高中化学 来源: 题型:填空题
 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
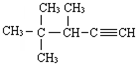 的系统名称为( )
的系统名称为( )| A. | 2,2,3一三甲基一1-戊炔 | B. | 3,4,4一三甲基一l一戊炔 | ||
| C. | 3,4,4一三甲基-2一戊炔 | D. | 2,2,3一三甲基一4一戊炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
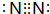 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2项 | B. | 3项 | C. | 4项 | D. | 5项 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该燃料绿色环保,在燃烧过程中不会造成任何环境污染 | |
| B. | 该反应中N2O4是氧化剂,偏二甲肼是还原剂 | |
| C. | N2既是氧化产物又是还原产物,CO2既不是氧化产物也不是还原产物 | |
| D. | 每有0.6 mol N2生成,转移电子数目为2.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、H+、SO42-、OH- | B. | Ca2+、Na+、NO3-、CO32- | ||
| C. | Na+、H+、CO32-、Cl- | D. | Na+、Cl-、SO42-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com