
【题目】铜及其化合物在工业上有广泛的用途,回答下列问题:
(1)硫酸铜是一种具有氧化性的盐.
①制备生氢剂CuH,完成下列反应方程式:H3PO2+CuSO4+=CuH+H3PO4+H2SO4生成的CuH易在氯气中燃烧,则完全燃烧的产物是 .
②硫酸铜溶液可与白磷发生反应,产物为磷酸、硫酸和铜,则此反应的氧化产物与还原产物的物质的量之比为 .
(2)碱式碳酸铜在有机催化剤、烟火制造和颜料、农药生产中有广泛的应用.某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备碱式碳酸铜的流程如图1: 
①辉铜矿在浸取前要ilfe富集与粉碎,粉碎的好处是 .
②浸取过程中得到一种单质,写出浸取时主要反应的化学方程式: .
③写出“沉锰”反应时离子方程式: .
(3)纳米Cu2O是一种新型光电材料,利用如图2所示的装置可制得,则工作中阳极上的电极反应式应 .
【答案】
(1)3;4;6H2O;4;3;4;CuCl2、HCl;2:5
(2)提高浸取速率;2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O;Mn2++NH3+HCO3﹣=MnCO3↓+NH4+
(3)2Cu+2OH﹣→Cu2O+H2O+2e﹣
【解析】解:(1)①该反应的还原产物只有CuH,氧化产物只有H3PO4 , 每生成1molCuH得3mol电子,每生成1mol磷酸失去4mol电子,据电子守恒和原子守恒,配平方程式为:4CuSO4+3H3PO2+6H2O═4CuH↓+4H2SO4+3H3PO4;CuH在氯气中完全燃烧会生成氯化铜和氯化氢,所以答案是:3、4、6H2O、4、3、4;CuCl2、HCl;②硫酸铜溶液与白磷反应,产物为磷酸、硫酸和铜,氧化产物磷酸,还原产物为Cu,每生成1molCu转移2mol电子,每生成1mol磷酸转移5mol电子,据电子守恒,氧化产物与还原产物的物质的量之比为2:5,所以答案是:2:5;(2)①酸浸时,通过粉碎矿石或者升高温度或者进行搅拌或都增加酸的浓度,都可以提高浸取速率,
所以答案是:提高浸取速率;②反应物是二氧化锰、硫化铜和硫酸,生成物是S、硫酸铜、硫酸锰,反应的方程式为2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,
所以答案是:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O;③“沉锰”(除Mn2+)过程,主要是使Mn2+生成沉淀MnCO3 , 反应的离子方程式为Mn2++NH3+HCO3﹣=MnCO3↓+NH4+ , 所以答案是:Mn2++NH3+HCO3﹣=MnCO3↓+NH4+;(3)铜电极作阳极,阳极上铜失电子和氢氧根离子反应生成氧化亚铜,电极反应式为:2Cu+2OH﹣→Cu2O+H2O+2e﹣ , 所以答案是:2Cu+2OH﹣→Cu2O+H2O+2e﹣ .


科目:高中化学 来源: 题型:
【题目】判断含氧酸强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强.含氧酸酸性强弱与非羟基氧原子数的关系如表所示:
含氧酸 | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
结构式 | Cl﹣OH |
|
|
|
非羟基氧原子数 | 0 | 1 | 2 | 3 |
酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
已知:亚磷酸(H3PO3)和亚砷酸(H3AsO3)分子式相似,但它们的酸性差别很大,H3PO3是中强酸,H3AsO3既有弱酸性又有弱碱性.由此可推出:
①H3PO3的结构式为 , H3PO3与过量的NaOH溶液反应的化学方程式为;
②H3AsO3的结构式为 , 在H3AsO3中加入浓盐酸,反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于原电池的电池名称,叙述有错误的是 ( )
A. 发生氧化反应的为负极B. 正极为电子流入的一极
C. 比较不活泼的金属为负极D. 电流表偏向的为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+ . 为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜.请根据流程图,在方框和括号内填写物质名称(或主要成分的化学式)或操作方法,完成回收硫酸亚铁和铜的简单实验方案. 
(1)操作②的名称为 , 所需要的玻璃仪器为、、烧杯.
(2)试剂⑤的化学式为 , 所发生的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生的绿色能源,CO2是一种温室气体,它们都是重要的化工原料.
(1)已知CO的燃烧热△H为﹣283kJmol﹣1 , CO (g)+2H2 (g)CH3OH (1);△H=﹣129kJmol﹣1 , 欲求出CH3OH的燃烧热,则需要知道一个反应,该反应的热化学方程式为 . (反应热直接用△H表示).
(2)向温度不同容积均为1L的a、b、c、d、e五个恒容密闭容器中各充入3molCO2、7molH2O的混合气体,控制适当条件使其同时发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=QkJmol﹣1 , 反应过程中维持各容器温度不变,测得t1时刻各容器中H2O的体积分数(H2O) 如图所示. 
①Q(填“>”或“<”),五个容器中肯定处于非平衡状态的是
②t1时刻时,容器a中正反应速率(填“大于”“小于”或“等于”)容器e中正反应速率.
③Td℃时,该反应的平衡尝试K= .
④欲提高H2的转化率,可采取的措施有(写出两种).
(3)碳捕捉技术的应用既可降低碳排放也可得到重要的化工产品.
①NaOH溶液是常用的碳捕捉剂,若某次捕捉后得到的溶液中c(HCO3﹣):c(CO32﹣)=2:1,则所得溶液的pH=[常温下 K1(H2CO3)=4.4×10﹣7、K2 (HCO3﹣)=5x 1O﹣11].
②在清除锅炉水垢的过程中,需要用Na2CO3将水垢中的CaSO4转化为CaCO3 , 将微溶的CaSO4难溶性的CaCO3的理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏伽德罗常数,下列说法正确的是( )
A.0.1 molNa2O2与足量的CO2充分反应转移的电子数为0.2NA
B.常温常压下,18g H2O 所含的中子数为8NA
C.0.1 mol铁在0.1 mol Cl2中充分燃烧,有0.3NA个电子转移
D.将含0.1 mol FeCl3的饱和溶液制成胶体后,生成的Fe(OH)3胶粒数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 ![]() 在不同条件下至少可能发生不同类型的反应:①取代反应 ②加成反应 ③消去反应 ④氧化反应 ⑤酯化反应,⑥加聚反应,其中由于其分子结构中含有﹣OH,可能发生的反应有( )
在不同条件下至少可能发生不同类型的反应:①取代反应 ②加成反应 ③消去反应 ④氧化反应 ⑤酯化反应,⑥加聚反应,其中由于其分子结构中含有﹣OH,可能发生的反应有( )
A.②④
B.①③④⑤⑥
C.②③④⑤
D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种有机物C4H4其分子结构如图所示,有关该分子说法正确的是( ) 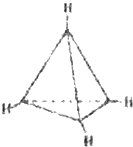
A.该分子是极性分子
B.每个碳原子均为sp2杂化
C.分子中有极性键和非极性键
D.分子中共有4个碳碳键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com