
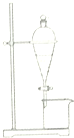
| A. | 用CCl4提取碘水中的碘 | |
| B. | 用NaOH溶液除去溴苯中的溴 | |
| C. | 用酒精除去苯酚中的甘油 | |
| D. | 用饱和Na2CO3溶液除去乙酸丁酯中的乙酸 |
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
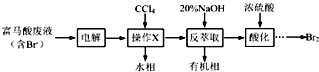

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
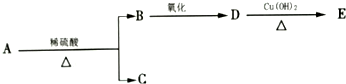 分子式为C9H18O2的有机物A有下列转化关系:其中B、C的相对分子质量相等,则A的可能的结构简式有( )
分子式为C9H18O2的有机物A有下列转化关系:其中B、C的相对分子质量相等,则A的可能的结构简式有( )| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应的化学方程式为:CO+H2O?CO2+H2 | |
| B. | 升高温度,v(正)、v(逆)都增大,且v(逆)增大更多 | |
| C. | 缩小容器体积,v(正)、v(逆)都增大,且v(正)增大更多 | |
| D. | 升高温度或缩小容器体积,混合气体的平均相对分子量都不会发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
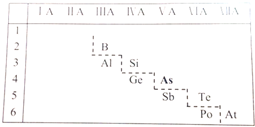
 ;砷蒸气的分子式:As4,其分子结构与白磷(P4)相似,也是正四面体,则As4中砷砷键的键角是60°.
;砷蒸气的分子式:As4,其分子结构与白磷(P4)相似,也是正四面体,则As4中砷砷键的键角是60°.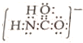 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
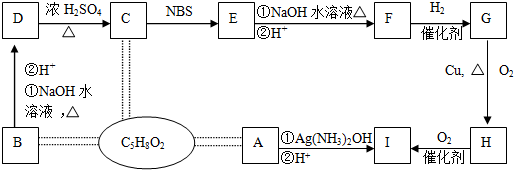
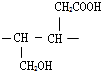 ;
;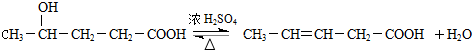 ;
;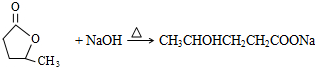 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com