
科目:高中化学 来源: 题型:阅读理解
A【物质结构与性质】纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。
 ⑴A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
⑴A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
①某同学根据上述信息,推断B的核外电子排布如右图所示,
该同学所画的电子排布图违背了 。
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为 。
 ⑵氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
⑵氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由 。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为 。
③继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 。
B【实验化学】某化学研究性学习小组为测定果汁中Vc含量,设计并进行了以下实验。
Ⅰ 实验原理
 将特定频率的紫外光通过装有溶液的比色皿,一部分被吸收,通过对比入射光强度和透射光强度之间的关系可得到溶液的吸光度(用A表示,可由仪器自动获得)。吸光度A的大小与溶液中特定成分的浓度有关,杂质不产生干扰。溶液的pH对吸光度大小有一定影响。
将特定频率的紫外光通过装有溶液的比色皿,一部分被吸收,通过对比入射光强度和透射光强度之间的关系可得到溶液的吸光度(用A表示,可由仪器自动获得)。吸光度A的大小与溶液中特定成分的浓度有关,杂质不产生干扰。溶液的pH对吸光度大小有一定影响。
Ⅱ 实验过程
⑴配制系列标准溶液。分别准确称量质量为1.0mg、1.5mg、2.0mg、2.5mg的标准Vc试剂,放在烧杯中溶解,加入适量的硫酸,再将溶液完全转移到100mL容量瓶中定容。
上述步骤中所用到的玻璃仪器除烧杯、容量瓶外还有 。
⑵较正分光光度计并按顺序测定标准溶液的吸光度。为了减小实验的误差,实验中使用同一个比色皿进行实验,测定下一溶液时应对比色皿进行的操作是 。测定标准溶液按浓度 (填“由大到小”或“由小到大”)的顺序进行。
⑶准确移取10.00mL待测果汁样品到100mL容量瓶中,加入适量的硫酸,再加水定容制得待测液,测定待测液的吸光度。
Ⅲ 数据记录与处理
 ⑷实验中记录到的标准溶液的吸光度与浓度的关系如下表所示,根据所给数据作出标准溶液的吸光度随浓度变化的曲线。
⑷实验中记录到的标准溶液的吸光度与浓度的关系如下表所示,根据所给数据作出标准溶液的吸光度随浓度变化的曲线。
| 标准试剂编号 | ① | ② | ③ | ④ | 待测液 |
| 浓度mg/L | 10 | 15 | 20 | 25 | — |
| pH | 6 | 6 | 6 | 6 | 6 |
| 吸光度A | 1.205 | 1.805 | 2.405 | 3.005 | 2.165 |
⑸原果汁样品中Vc的浓度为 mg/L
⑹实验结果与数据讨论
除使用同一个比色皿外,请再提出两个能使实验测定结果更加准确的条件控制方法 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
A.(12分)CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
已知:①CuCl可以由CuCl2用适当的还原剂如S02、SnCl2等还原制得:
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:
请回答下列问题:
(1)基态Cu原子的核外电子排布式为______________。H、N、O三种元素的电负性由大到小的顺序是_____。
(2)SO2分子的空间构型为____。与SnCl4互为等电子体的一种离子的化学式为______
(3)乙二胺分子中氮原子轨道的杂化类型为_______。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是______________________。
(4)②中所形成的配离子中含有的化学键类型有__________。
a.配位键 b.极性键 c.离子键 d.非极性键
(5)CuCl的晶胞结构如右图所示,其中Cl原子的配位数为_________。
B.(12分)某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
步骤Ⅰ:称取0.4g花生油样品,置于两个干燥的碘瓶(如图)内,加入10mL四氯化碳,轻轻摇动使油全部溶解。向碘瓶中加入25.00mL含0.01mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失。
步骤Ⅱ:在暗处放置30min,并不时轻轻摇动。30min后,小心地打开玻璃塞,用新配制的10%碘化钾10mL和蒸馏水50mL把玻璃塞和瓶颈上的液体冲洗入瓶内。
步骤Ⅲ:加入指示剂,用0.1mol·L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点。
测定过程中发生的相关反应如下:
① ②IBr+KI=I2+KBr ③I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应用 ,用方程式表示碘瓶必须干燥的原因 。
(2)步骤Ⅱ中碘瓶在暗处放置30min,并不时轻轻摇动的原因是 。
(3)步骤Ⅲ中所加指示剂为 ,滴定终点的现象 。
(4)反应结束后从液体混合物中回收四氯化碳,则所需操作有 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省泰州市高三第一次模拟考试化学卷 题型:实验题
(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容,请选择其中—题,并在相应的答题区域作答。若两题都做,则按A题评分。
A.镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)请参考下述数据填空和回答问题:

工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝。不用电解MgO的方法生产镁的原因 ;不用电解AlCl3的方法生产铝的原因 。
(2)2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的晶胞如图所示。镁原子间形成正六棱柱,六个硼原子位于棱柱内。则该化合物的化学式可表示为 。

(3)写出Cu+的核外电子排布式 。
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是 。
(5)某喹喏酮类药物(中心离子是Cu2+)结构如下图,关于该药物的说法正确的是 。

A.中心离子Cu2+的配位数是5
B.N原子均采用sp2杂化
C.存在配位键、极性共价键和非极性共价键
D.熔点很高,硬度很大
B.某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
步骤I:称取0.4 g花生油样品,置于两个干燥的碘瓶(如图)内,加入10 mL四氯化碳,轻轻摇动使油全部溶解。向碘瓶中加入25.00 mL含0.01 mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失。

步骤II:在暗处放置30 min,并不时轻轻摇动。30 min后,小心地打开玻璃塞,用新配制的10%
碘化钾10 mL和蒸馏水50 mL把玻璃塞和瓶颈上的液体冲洗入瓶内。
步骤Ⅲ:加入指示剂,用0.1 mol·L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点。
测定过程中发生的相关反应如下:
①
②IBr+KI=I2+KBr
③I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应选用的仪器是 ,碘瓶不干燥会发生反应的化学方程式 。
(2)步骤Ⅱ中碘瓶在暗处放置30 min,并不时轻轻摇动的原因是 。
(3)步骤Ⅲ中所加指示剂为 ,滴定终点的现象 。
(4)反应结束后从液体混合物中回收四氯化碳,所需操作有 。
查看答案和解析>>
科目:高中化学 来源:2010年江苏省高三第四次模拟考试化学试题 题型:填空题
A.(12分)CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
已知:①CuCl可以由CuCl2用适当的还原剂如S02、SnCl2等还原制得:

②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:
请回答下列问题:
(1)基态Cu原子的核外电子排布式为______________。H、N、O三种元素的电负性由大到小的顺序是_____。
(2)SO2分子的空间构型为____。与SnCl4互为等电子体的一种离子的化学式为______
(3)乙二胺分子中氮原子轨道的杂化类型为_______。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是______________________。
(4)②中所形成的配离子中含有的化学键类型有__________。
a.配位键 b.极性键 c.离子键 d.非极性键
(5)CuCl的晶胞结构如右图所示,其中Cl原子的配位数为_________。

B.(12分)某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
步骤Ⅰ:称取0.4g花生油样品,置于两个干燥的碘瓶(如图)内,加入10mL四氯化碳,轻轻摇动使油全部溶解。向碘瓶中加入25.00mL含0.01mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失。

步骤Ⅱ:在暗处放置30min,并不时轻轻摇动。30min后,小心地打开玻璃塞,用新配制的10%碘化钾10mL和蒸馏水50mL把玻璃塞和瓶颈上的液体冲洗入瓶内。
步骤Ⅲ:加入指示剂,用0.1mol·L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点。
测定过程中发生的相关反应如下:
① ②IBr+KI=I2+KBr
③I2+2S2O32-=2I-+S4O62-
②IBr+KI=I2+KBr
③I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应用 ,用方程式表示碘瓶必须干燥的原因 。
(2)步骤Ⅱ中碘瓶在暗处放置30min,并不时轻轻摇动的原因是 。
(3)步骤Ⅲ中所加指示剂为 ,滴定终点的现象 。
(4)反应结束后从液体混合物中回收四氯化碳,则所需操作有 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
氢是新型清洁能源,但难储运。研究发现,合金可用来储藏氢气。镧(![]() ) 和镍(
) 和镍(![]() ) 的一种合金就是储氢材料。该合金的晶胞如下图,镍原子除一个在中心外,其他都在面上,镧原子在顶点上。储氢时氢原子存在于金属原子之间的空隙中。
) 的一种合金就是储氢材料。该合金的晶胞如下图,镍原子除一个在中心外,其他都在面上,镧原子在顶点上。储氢时氢原子存在于金属原子之间的空隙中。

(1)一定条件下,该贮氢材料能快速、可逆地存储和释放氢气,若每个晶胞可吸收 3 个 H2, 这一过程用化学方程式表示为: 。
(2)下列关于该贮氢材料及氢气的说法中,正确的是 ( 填序号 )
A.该材料中镧原子和镍原子之间存在化学键,是原子晶体
B.氢分子被吸收时首先要在合金表面解离变成氢原子,同时放出热量
C.该材料贮氢时采用常温高压比采用常温常压更好
D.氢气很难液化是因为虽然其分子内氢键很强,但其分子间作用力很弱
E.已知镧和镍的第一电离能分别为 5.58eV、7.64eV, 可见气态镧原子比气态镍原子更容易变成+1 价的气态阳离子
(3)某研究性学习小组查阅的有关镍及其化合物的性质资料如下:

①写出 Ni3+ 的核外电子排布式:
②写出将NiO(OH) 溶于浓盐酸的离子方程式:
(4)Ni(CO)6为正八面体结构,镍原子位于正八面体的中心,配位体CO在正八面体的六个顶点上。若把其中两个CO配位体换成 NH3 得到新的配合物,则以下物质中互为同分异构体的是 。 ( 填字母编号,任填一组 )( 图中黑点为NH3,圆圈为CO,Ni略去)
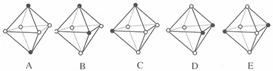
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com