
| A. | NH4CNO和CO(NH2)2 | B. | CH2OHCHO和CH3COOH | ||
| C. | CH3OOCCH3和CH3COOCH3 | D. | 甘氨酸和CH3 CH2NO2 |
分析 同分异构体是指分子式相同,但结构不同的化合物,同分异构体包含碳链异构、官能团异构、位置异构等,以此来解答.
解答 解:A.NH4CNO和CO(NH2)2的分子式都为CH4N2O,二者结构不同,属于同分异构体,故A正确;
A.CH2OHCHO和CH3COOH的分子式都为C2H4O2,二者结构不同,属于同分异构体,故B正确;
A.CH3OOCCH3和CH3COOCH3的分子式都为CH4N2O,二者结构相同,属于同种物质,故C错误;
A.甘氨酸(NH2CH2COOH)和CH3 CH2NO2的分子式都为C2H5NO2,二者结构不同,属于同分异构体,故D正确;
故选C.
点评 本题考查了同分异构体的判断,难度不大,侧重对基础知识的巩固,根据物质名称确定结构是关键.


科目:高中化学 来源: 题型:推断题
 ;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.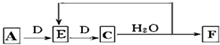
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

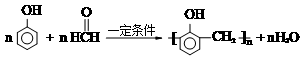 ,福尔马林是甲醛含量37%的水溶液,它的一个用途是浸制生物标本.
,福尔马林是甲醛含量37%的水溶液,它的一个用途是浸制生物标本.| 甲同学选择的试剂 | 乙同学认为不合理的理由 |
| 紫色石蕊试液 | |
| 新制氢氧化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:5 | C. | 3:2 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
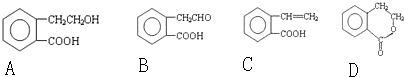
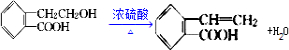 .
.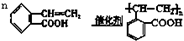 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol•L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c( S2O82-)/mol•L-1 | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com