
| A. | 闻名世界的中国陶瓷、酿酒、造纸技术都充分应用了化学工艺 | |
| B. | 植物油和矿物油都是碳氢化合物 | |
| C. | 光导纤维维、合成纤维和玻璃纤维都是新型无机非金属材料 | |
| D. | 蛋白质的水解和油脂的皂化都是由高分子生成小分子的过程 |
分析 A.陶瓷、酿酒、造纸等工艺过程中都发生了化学变化,充分应用了化学工艺;
B.植物油由C、H、O三种元素组成;
C.合成纤维是有机非金属材料,光导纤维是新型无机非金属材料;
D.油脂不是高分子化合物.
解答 解:A.烧制陶瓷的原理:瓷器是以粘土为主要原料以及各种天然矿物经过粉碎混炼、成型和煅烧制得的材料以及各种制品,有新物质生成,属于化学工艺.酿酒的过程中有新物质酒精生成,属于我国古代化学工艺.造纸,应用了将打碎的纤维浆漂白这一环节,有新物质生成,中国陶瓷、酿酒、造纸技术是我国古代在世界上享有盛名的三大化学工艺,故A正确;
B.汽油、柴油是碳氢化合物,植物油由C、H、O三种元素组成故不是碳氢化合物,故B错误;
C.合成纤维是有机非金属材料,光导纤维是新型无机非金属材料;故C错误;
D.高分子化合物的相对分子质量在10000以上,油脂不是分子化合物,故D错误.
故选A.
点评 本题考查较为综合,涉及四大发明、植物油和矿物油成分、材料分类等,为高考常见题型和高频考点,侧重于基础知识的考查,注意学习时理论联系实际,题目难度不大.


科目:高中化学 来源: 题型:解答题
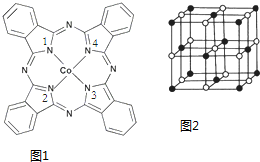
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
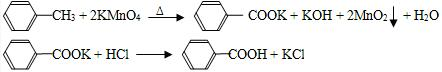
 ─CH3+6KMnO4→3
─CH3+6KMnO4→3 ─COOK+6MnO2+3KOH+3H2O
─COOK+6MnO2+3KOH+3H2O ─COOK+HCl→
─COOK+HCl→ ─COOH+KCl
─COOH+KCl| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |

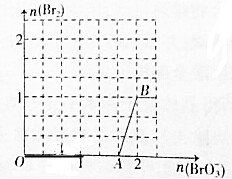
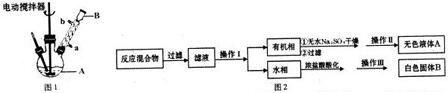
 ,操作Ⅱ为蒸馏.
,操作Ⅱ为蒸馏.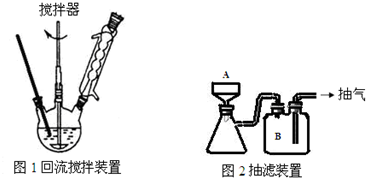
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
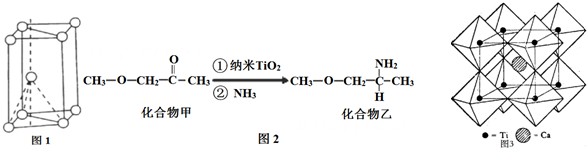
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H10的属于烷烃的同分异构体有3种 | |
| B. | 分子组成是C5H10属于烯烃的同分异构体有6种 | |
| C. | 分子组成是C4H8O属于醛类的同分异构体有3种 | |
| D. | 结构为 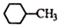 的物质的一溴代物有5种 的物质的一溴代物有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C和D能形成D2C2的离子化合物 | |
| B. | 由A、D原子构成的分子的结构是正四面体 | |
| C. | E和C只能形成E2C 一种化合物 | |
| D. | 由A、B、C、D四种元素形成的化合物可以是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物稳定性:PH3>CH4 | |
| B. | HCl的电子式为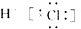 | |
| C. | D2O分子所有原子均达到最外层8e-稳定结构 | |
| D. | VIIA族元素中F的最高价氧化物对应水化物酸性最强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com