
| A. | 常温常压下,4.6 g NO2气体约含有1.81×1023个原子 | |
| B. | 在标准状况下,80 gSO3所占的体积约为22.4L | |
| C. | 常温下,0.1 mol/L醋酸溶液的pH约为1 | |
| D. | 标准状况下,22.4L氯气与足量氢氧化钠溶液反应,转移的电子数为2NA |
分析 A.常温常压下,4.6 g NO2气的物质的量是0.1mol,原子物质的量为二氧化氮的3倍,再根据N=nNA计算;
B.在标准状况下,SO3是固体,不能使用气体摩尔体积;
C.醋酸是弱酸,在溶液中只有很少以部分发生电离;
D.在标准状况下,22.4L氯气的物质的量是1mol与足量氢氧化钠溶液反应生成氯化钠、次氯酸钠,氯气起氧化剂、还原剂作用,各占一半.
解答 解:A.常温常压下,4.6 g NO2气的物质的量是0.1mol,所以约含有0.1×3×6.02×1023=1.81×1023个原子,故A正确;
B.在标准状况下,SO3是固体,不能使用气体摩尔体积计算其体积,故B错误;
C.醋酸是弱酸,在溶液中只有很少以部分发生电离,因此在常温下,0.1 mol/L醋酸溶液的pH大于1,故C错误;
D.在标准状况下,22.4L氯气的物质的量是1mol,与足量氢氧化钠溶液反应生成氯化钠、次氯酸钠,氯气起氧化剂、还原剂作用,各占一半,故转移的电子数为NA,故D错误,
故选A.
点评 本题考查物质的量的有关计算,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,2 mol•L-1的醋酸溶液与1 mol•L-1的醋酸溶液中的c(H+)之比 | |
| B. | H2CO3水溶液中c(H+)与c(CO32-)之比 | |
| C. | Na2CO3溶液中c(Na+)与c(CO32-)之比 | |
| D. | 常温下,0.1 mol•L-1Na2CO3溶液与0.1 mol-1CH3COONa溶液中c(Na+)之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向足量的NaHCO3溶液中逐渐滴入澄清石灰水:Ca2++2OH-+2HCO3-═2H2O+CaCO3↓+CO32- | |
| B. | 向足量的NaHSO4溶液中逐渐滴入Ba(HCO3)2溶液:Ba2++2H++2HCO3-+SO42-═2H2O+BaSO4↓+2 CO2↑ | |
| C. | 向饱和Na2CO3溶液中通入足量的CO2:CO32-+CO2+H2O═2HCO3- | |
| D. | 向NaHSO4溶液中逐渐滴入Ba(OH)2溶液至沉淀完全:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液中Na+浓度增大,有O2放出 | B. | 溶液的碱性不变,有H2放出 | ||
| C. | 溶液中Na+数目减少,有O2放出 | D. | 溶液的碱性不变,有O2放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子是一种呈正四面体型的、含极性键的非极性分子 | |
| B. | 甲烷分子中两个氢原子被氯取代后,可形成两种不同结构的分子 | |
| C. | 甲烷是重要的化工原料,其分解产物可用于合成氨和橡胶工业 | |
| D. | “抽”出坑道中的甲烷,既可用作清洁燃料,又可防止爆炸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
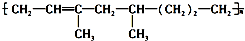 下列有关其叙述不正确的是( )
下列有关其叙述不正确的是( )| A. | 该高聚物是通过加聚反应生成的 | |
| B. | 合成该高聚物的单体有三种 | |
| C. | 1mol该物质能与1molH2加成,生成不含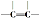 的物质 的物质 | |
| D. | 该高聚物能被酸性KMnO4溶液氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com