
分析 (1)Al2(SO4)3是强酸弱碱盐,水解溶液呈酸性;
(2)碳酸氢钠是强碱弱酸的酸式盐,碳酸氢根离子的水解程度大于电离程度,所以溶液呈碱性;
(3)NaHCO3水解溶液呈碱性,Al2(SO4)3在溶液中水解显酸性,二者混合发生相互促进的水解,生成二氧化碳和氢氧化铝.
解答 解:(1)Al2(SO4)3是强酸弱碱盐,水解溶液呈酸性,水解的离子方程式为:Al3++3H2O?Al(OH)3+3H+,故答案为:酸性; Al3++3H2O?Al(OH)3+3H+;(2)碳酸氢钠是强碱弱酸的酸式盐,碳酸氢根离子的水解程度大于电离程度,水解的离子方程式为:HCO3-+H2O?H2CO3+OH-,溶液呈碱性;故答案为:碱性; HCO3-+H2O?H2CO3+OH-;
(3)HCO3-水解,反应为:HCO3-+H2O?H2CO3+OH-,溶液呈碱性;Al3+水解,反应为:Al3++3H2O?Al(OH)3+3H+,Al2(SO4)3溶液呈酸性;NaHCO3溶液跟Al2(SO4)3溶液混合,发生相互促进的水解:3HCO3-+Al3+=3CO2↑+Al(OH)3↓,产生大量的气体和沉淀,故答案为:3HCO3-+Al3+=3CO2↑+Al(OH)3↓.
点评 本题考查了盐的水解、难溶电解质的溶解平衡,侧重于基础知识的考查,难度不大,注意把握盐类水解的实质和应用.


科目:高中化学 来源: 题型:选择题
| A. | 原子中2p能级比2s能级多一个电子的第二周期元素 | |
| B. | 位于元素周期表中第三周期ⅢA族的元素 | |
| C. | 原子最外层电子排布为2s22p6的元素 | |
| D. | 原子最外层电子排布为2s22p5的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
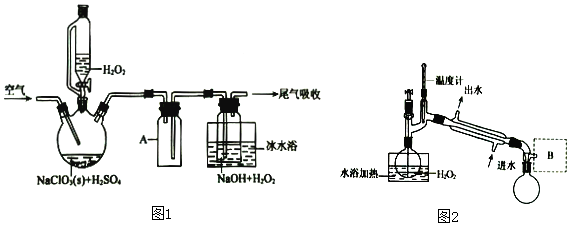
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
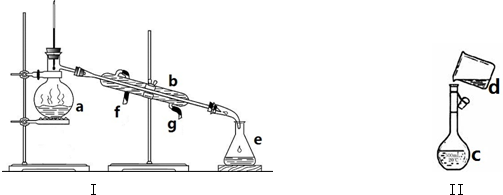
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1,3-丁二烯 | B. | 环丁二烯 | C. | 2-丁炔 | D. | 1-丁炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
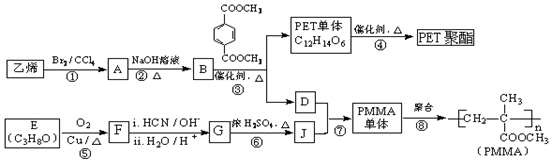
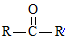 $→_{ii.H_{2}O/H+}^{i.HCN/OH-}$
$→_{ii.H_{2}O/H+}^{i.HCN/OH-}$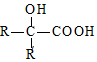 (R、R′代表烃基)
(R、R′代表烃基) .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属及其化合物在化学中扮演着重要的角色,试根据各物质的性质完成下列问题:(1)钠与水反应时,钠漂浮在水面上.甲同学用刺有小孔的铝箱将0.46g钠包裹,而后投入水中,使钠沉入水底与水(足量)反应.反应结束后,生成的气体体积大于(填“大于”“小于”或“等于”) 224mL (标准状况).
金属及其化合物在化学中扮演着重要的角色,试根据各物质的性质完成下列问题:(1)钠与水反应时,钠漂浮在水面上.甲同学用刺有小孔的铝箱将0.46g钠包裹,而后投入水中,使钠沉入水底与水(足量)反应.反应结束后,生成的气体体积大于(填“大于”“小于”或“等于”) 224mL (标准状况). CuSO4+SO2↑+2H2O,生成SO2的物质的量小于0.46mol的原因是随着反应的进行硫酸的浓度逐渐减小,铜不与稀硫酸反应,所以产生SO2的物质的量小于0.46mol.
CuSO4+SO2↑+2H2O,生成SO2的物质的量小于0.46mol的原因是随着反应的进行硫酸的浓度逐渐减小,铜不与稀硫酸反应,所以产生SO2的物质的量小于0.46mol.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com