
将pH=3的盐酸a L分别与下列三种溶液混合后,混合液均呈中性:
①1×10-3 mol·L-1的氨水b L
②c(OH-)=1×10-3 mol·L-1的氨水c L
③c(OH-)=1×10-3 mol·L-1的Ba(OH)2溶液d L
其中a、b、c、d的关系正确的是
A.b>a=d>c B.a=b>c>d
C.a=b>d>c D.c>a=d>b
科目:高中化学 来源:2015届甘肃省高三第一次诊断考试化学试卷(解析版) 题型:选择题
下列叙述中正确的个数是
①有新单质生成的化学反应一定是氧化还原反应。
②熵增且放热的反应一定是自发反应。
③Mg比A1活泼,在Mg和A1形成的原电池中,Mg必定做负极。
④难溶电解质的溶度积越小,则它的溶解度越小。
⑤燃烧热是指1 mol可燃物完全燃烧生成氧化物时所释放的能量。
⑥干燥的C12和氯水均能使鲜花褪色
A.1 B.2 C.3 D.4
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省天水市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A.硫粉在过量的纯氧中燃烧可以生成大量的SO2
B.可以用品红溶液鉴别SO2和CO2
C.SO2能使品红溶液、酸性KMnO4溶液褪色,但褪色原理不同
D.少量SO2通过CaCl2的溶液能生成白色沉淀
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省天水市高三上学期期中考试化学试卷(解析版) 题型:选择题
M是苯的同系物,其结构为 ,则M的结构式共有
,则M的结构式共有
A . 16 种 B . 12 种 C . 8种 D . 10 种
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省天水市高二上学期期中考试化学(理)试卷(解析版) 题型:填空题
(17分)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g)  2NH3(g) △H= -92.4 kJ/mol,据此回答以下问题:
2NH3(g) △H= -92.4 kJ/mol,据此回答以下问题:
(1)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是 (填序号)。
①反应压强为20Mpa~50Mpa
②500℃的高温
③铁触媒作催化剂
④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中。
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示(T-温度)。则T2 T1(填>、=、<),
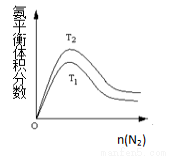
判断的依据是: 。(3分)
(3)合成氨气所需的氢气可以由水煤气分离得到。
涉及反应信息如下:
反应一:C(s)+H2O(g)  H2(g)+CO(g) 平衡常数K1
H2(g)+CO(g) 平衡常数K1
反应二:CO(g)+H2O(g)  H2(g)+CO2(g) 平衡常数K2
H2(g)+CO2(g) 平衡常数K2
① K1的表达式:K1= 。(3分)
②将一定量的H2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
实验组别 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
3 | T | a | b | c | d | t |
(Ⅰ)实验1中,用CO2表示反应开始到平衡的平均反应速率为 。
(Ⅱ)在实验3,当a=0.5、b=1时,要使c、d数据与实验2相同,且t<3,可以采取的措施为 (填序号)(3分)
A.其它条件不变温度T<900℃ B.其它条件不变温度T>900℃
C.充入一定量氖气 D.使用高效催化剂
(Ⅲ)对于反应二,当升高温度时K2 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省天水市高二上学期期中考试化学(理)试卷(解析版) 题型:选择题
常温下,浓度均为0.1 mol/L的6种盐溶液pH如下:
溶质 | Na2CO3 | NaHCO3 | Na2SiO3 | Na2SO3 | NaHSO3 | NaCl O |
pH | 11.6 | 9.7 | 12.3 | 10.0 | 4.0 | 10.3 |
下列说法正确的是
A.Cl2和Na2CO3按物质的量之比1:1反应的化学方程式为:Cl2+Na2CO3+H2O=HClO+NaHCO3+NaCl
B.相同条件下电离程度比较:HCO3->HSO3->HClO
C.6种溶液中,Na2SiO3溶液中水的电离程度最小
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO3-)>c(SO32‑)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省天水市高二上学期期中考试化学(理)试卷(解析版) 题型:选择题
常温时,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.某溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,该溶液pH一定为14-a
B.0.1mol/L的KHA溶液,其pH=10,c(K+)>c(A2-)>c(HA-) >c(OH-)
C.将0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(HA)>C(Na+)>c(A-)
D.等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高三9月月考化学试卷(解析版) 题型:填空题
(10分)硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2(约45%)、Fe2O3(约40%)、Al2O3(约10%)和MgO(约5%)。某同学设计了如下方案,分离样品中各种金属元素。请回答下列问题。

(1)写出溶液B的溶质是 。
(2)参照以下框图形式进一步完成“溶液C”到“Al2O3”的流程(注明试剂、条件和操作) 。
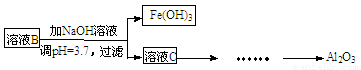
(3)为了分析某硫酸渣中铁元素的含量,先将硫酸渣预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。写出反应的离方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com