


科目:高中化学 来源:不详 题型:填空题
 xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L?min),请填写下列空白:
xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L?min),请填写下列空白:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学反应的实质是旧键的断裂,新键的形成 |
| B.石墨转化为金刚石的反应是吸热反应,说明金刚石比石墨稳定 |
| C.原电池反应的实质是自发进行的氧化还原反应 |
| D.元素周期律的实质是元素原子核外电子排布呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.稳定性: PH3、H2S 、H2O、HF |
| B.酸性: H2CO3 、H2SO4、HClO4、HNO3 |
| C.与氢气反应的难易程度:F2、Cl2、Br2 、I2 |
| D.碱性: NaOH KOH RbOH CsOH |
查看答案和解析>>
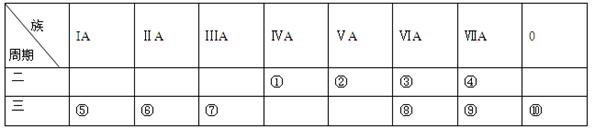
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.②③④ | C.①②④ | D.①③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Y的最高价氧化物可与氢氧化钠溶液反应 |
| B.最高价氧化物的水化物酸性 Z>X |
| C.气态氢化物的稳定性 Z>W |
| D.原子半径 Z>Y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com