
| A. | 转移溶液后未洗涤烧杯和玻璃棒就直接定容 | |
| B. | 称量时左码右物 | |
| C. | 定容后把容量瓶倒转摇匀,发现液面低于刻度,再滴加几滴水至刻度线 | |
| D. | 在容量瓶中进行定容时俯视刻度线 |
科目:高中化学 来源: 题型:选择题
| A. | 1 mol的CH4质量为16g/mol | |
| B. | 3.01×1023个CO2分子的质量约为22g | |
| C. | H2O的摩尔质量为18g | |
| D. | 标准状况下,1 mol任何物质体积均为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
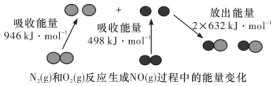 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )| A. | 1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ | |
| B. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| C. | 在1 L的容器中发生反应,10 min内 N2 减少了1 mol,因此10 min内的平均反应速率为v(NO)=0.1 mol/(L•min) | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
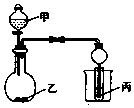 用如图装置进行实验,将少量液体甲逐滴加入到固体乙中,试管中试剂为丙,则下表中对应选项正确的是 ( )
用如图装置进行实验,将少量液体甲逐滴加入到固体乙中,试管中试剂为丙,则下表中对应选项正确的是 ( ) | 甲 | 乙 | 丙 | 试管中的现象 | |
| A | 浓硫酸 | 亚硫酸钠 | 石蕊试液 | 先变红后褪色 |
| B | 浓硝酸 | 铜 | KI-淀粉溶液 | 溶液变蓝色 |
| C | 醋酸 | 粉末状贝壳 | BaCl2溶液 | 变浑浊 |
| D | 浓氨水 | 生石灰 | FeCl2溶液 | 最后生成白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com