
 2016年10月11日,神舟十一号飞船搭乘CZ-2F火箭成功发射.在重达495 吨的起飞重量中,95%的都是化学推进剂.
2016年10月11日,神舟十一号飞船搭乘CZ-2F火箭成功发射.在重达495 吨的起飞重量中,95%的都是化学推进剂. (C7H10)是一种重要的高密度液体燃料化学推进剂.已知:
(C7H10)是一种重要的高密度液体燃料化学推进剂.已知:| 燃料 | 密度(g•cm-3) | 体积热值(J•L-1) |
| 降冰片烯 | 1.0 | 4.2×107 |
分析 (1)C7H10的摩尔质量为94g/mol,故燃烧1mol降冰片烯标准燃烧热为△H=-$\frac{94g/mol}{1×1{0}^{3}g•{L}^{-1}}$×4.2×107J/L=-3948kJ/mol,故热化学方程式为C7H10(l)+9.5O2(g)=7CO2(g)+5H2O(l)△H=-3948kJ/mol;
(2)①①CO2(g)+3H2(g)?CH3OH(g)+H2O(l)△H1
②2H2(g)+O2(l)═2H2O(l)△H2
③CH3OH(g)═CH3OH(l)△H3,3×②-2×①-2×③得,2CH3OH(l)+3O2(l)═2CO2(g)+4H2O(l)△H4=3△H2-2△H1-2△H3,据此进行分析;
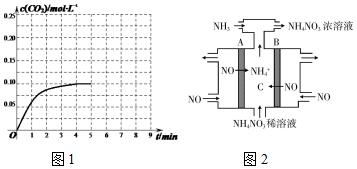
②据k=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$进行计算;反应物浓度增大,使平衡不断向正反应方向进行,据此作图;
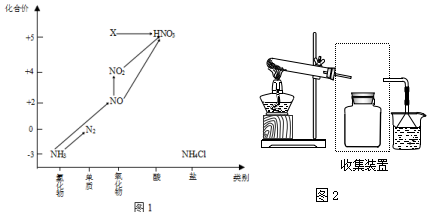
(3)由图可知,A极上NO生成NH4+,发生还原反应,为电解池阴极,B极上NO生成NO3-,发生氧化反应,据此书写电极反应方程式;
解答 解:(1)C7H10的摩尔质量为94g/mol,故燃烧1mol降冰片烯标准燃烧热为△H=-$\frac{94g/mol}{1×1{0}^{3}g•{L}^{-1}}$×4.2×107J/L=-3948kJ/mol,故热化学方程式为C7H10(l)+9.5O2(g)=7CO2(g)+5H2O(l)△H=-3948kJ/mol,
故答案为:C7H10(l)+9.5O2(g)=7CO2(g)+5H2O(l)△H=-3948kJ/mol;
(2)①①CO2(g)+3H2(g)?CH3OH(g)+H2O(l)△H1
②2H2(g)+O2(l)═2H2O(l)△H2
③CH3OH(g)═CH3OH(l)△H3,3×②-2×①-2×③得,2CH3OH(l)+3O2(l)═2CO2(g)+4H2O(l)△H4=3△H2-2△H1-2△H3,故△H4=3△H2-2△H1-2△H3,
故答案为:3△H2-2△H1-2△H3;
②CO2(g)+3H2(g)?CH3OH (g)+H2O(g)
开始(c) 0 0 0.5 0.5
变化 0.1 0.3 0.1 0.1
平衡 0.1 0.3 0.4 0.4,k=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$=$\frac{0.4×0.4}{0.2×0.{3}^{3}}$=59.26;反应物浓度增大,使平衡不断向正反应方向进行,故图为 ,
,
故答案为:59.26; ;
;
(3)由图可知,A极上NO生成NH4+,发生还原反应,为电解池阴极;B极上NO生成NO3-,发生氧化反应,故电极反应方程式为NO-3e-+2H2O=NO3-+4H+,
故答案为:阴;NO-3e-+2H2O=NO3-+4H+.
点评 本题考查热化学方程式的书写,燃烧热的计算,化学平衡常数的计算,电极反应方程式的书写,本题难度中等.


科目:高中化学 来源: 题型:实验题
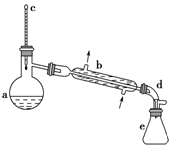 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图: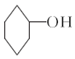 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O,
+H2O,| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
 ,生成该物质的反应类型是取代反应
,生成该物质的反应类型是取代反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 | |
| B. | 12g石墨中含有σ键的个数为2NA (NA表示阿伏伽德罗常数) | |
| C. | 氯化铯晶体中,每个Cs+周围紧邻8个Cl- | |
| D. | 干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | ||
| T |
| A. | 元素X、W、Z在自然界中均可以游离态存在 | |
| B. | 元素X、Y、W的原子半径依次递增 | |
| C. | 实验室储存T的单质时,应在其表面覆盖少量的水 | |
| D. | 元素Z的氧化物是制作计算机芯片的材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
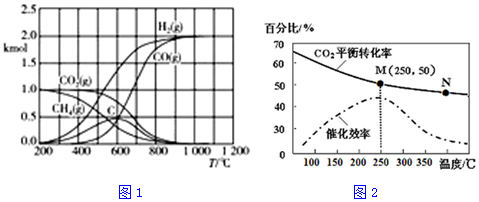
| 化学键 | C≡O | C=O | C-H | H-H |
| 能量/kJ•mol-1 | 1074 | 803 | 413 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com