
【题目】三氧化二锰(Mn2O3)在现代工业上应用广泛。以软锰矿(主要成分为MnO2)和硫锰矿(主要成分为MnS)为原料制备高纯度硫酸锰进而制备三氧化二锰的工艺流程如下(两种矿物中均不存在单质杂质):
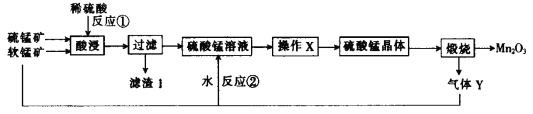
(1)MnS、Mn2O3、MnO2中锰元素的化合价均不同,已知锰有多种化合价,请再写出两种含锰且锰的化合价不同的化合物的化学式:______________。
(2)滤渣1中存在一种非金属单质,则“酸浸”时反应①的化学方程式为________________。
(3)操作X为蒸发浓缩、________、________、洗涤烘干。经操作X之后得到MnSO4H2O。在洗涤操作中,常用酒精洗涤MnSO4H2O晶体,主要目的是_______________________。
(4)气体Y直接排放会污染空气,将Y的水溶液与软锰矿反应可得硫酸锰,反应②的化学方程式为______。
(5)Mn2O3与MnO2类似,也能与浓盐酸反应,其反应的离子方程式为____________。
(6)用标准的BaCl2溶液测定样品中MnSO4H2O的质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其原因可能是_________________(任写一点)。
【答案】K2MnO4、KMnO4 MnO2+MnS+2H2SO4=2MnSO4+S+2H2O 冷却结晶 过滤 减少MnSO4H2O的损失 MnO2+SO2=MnSO4 Mn2O3+6H++2Cl-(浓)![]() 2Mn2++Cl2↑+3H2O 混有硫酸盐杂质
2Mn2++Cl2↑+3H2O 混有硫酸盐杂质
【解析】
硫锰矿、软锰矿酸浸时生成硫酸锰、单质硫,则滤渣中含有硫;滤液为硫酸锰溶液,经蒸发浓缩、冷却结晶得到硫酸锰晶体,煅烧的到Mn2O3和二氧化硫。
(1)锰元素有多种化合价,还有+6价的K2MnO4和+7价的KMnO4;
(2)滤渣1中含有硫单质,是由+3价的Mn与-2价的S反应生成,方程式为MnO2+MnS+2H2SO4=2MnSO4+S+2H2O;
(3)制取硫酸锰晶体时,需要把溶液蒸发浓缩,冷却结晶,对固液进行过滤分离,洗涤,晾干即可;用酒精洗涤可降低硫酸锰晶体的溶解度,减少损失;
(4)气体Y为二氧化硫,与二氧化锰反应生成硫酸锰,方程式为MnO2+SO2=MnSO4;
(5)已知Mn2O3的性质和MnO2类似,与浓盐酸反应生成MnCl2和氯气、水,离子方程式为Mn2O3+6H++2Cl-(浓)![]() 2Mn2++Cl2↑+3H2O;
2Mn2++Cl2↑+3H2O;
(6)质量分数大于100%,说明硫酸锰晶体中的杂质为硫酸盐或部分晶体失去结晶水,导致计算出的硫酸锰晶体的质量偏大。


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】现有某XY3气体ag,它的摩尔质量为bg·mol1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为_____;
(2)该气体所含原子总数为____;
(3)该气体在标准状况下的体积为____;
(4)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为____;将该溶液加水稀释至原体积的2倍后,再取出50 mL稀释后的溶液,则取出溶液的物质的量浓度____;
(5)标准状况下,相同体积的另一种气体CH4全部转化成CO2时转移的电子的物质的量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验小组在“探究碘水与FeCl2溶液能否反应”的系列实验中发现:在足量的稀KI溶液中,加入1~2滴FeCl3溶液,振荡后溶液呈黄色。
(查阅资料)
碘微溶于水,碘的水溶液颜色随浓度变化呈现黄色或棕色,碘水中含有碘单质;含Fe3+的溶液也呈黄色。
(提出问题)
Fe3+、I2的氧化性强弱情况。
(提出猜想)
(1)甲同学认为氧化性I2>Fe3+,故上述实验现象不是发生化学反应所致,则溶液呈黄色是因为含______;乙同学认为氧化性Fe3+>I2,故上述实验现象是发生化学反应所致,则溶液呈黄色是因为含_______。
(设计实验并验证)
(2)为验证乙同学的观点正确,丙同学选用下面所提供的试剂设计出以下两种方案进行实验,请完成下列表格。供选用的试剂:a.酚酞试液 b.四氯化碳 c.无水酒精 d.KSCN溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
试剂 | 实验现象 | |
方案1 | ____________ | ______ |
方案2 | ______ | _________ |
(实验结论)
氧化性:Fe3+>I2。
(拓展应用)
(3)①根据上述实验推测,若在FeI2溶液中通入氯气,首先被氧化的离子是________。
②在100mL FeI2溶液中通入2.24LCl2(标准状况下),溶液中若有![]() 的Fe2+ 被氧化,用离子方程式表示该反应过程:___。
的Fe2+ 被氧化,用离子方程式表示该反应过程:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家正在研究尿素动力燃料电池,尿液也能发电。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电,尿素燃料电池结构如图所示,下列有关描述正确的是( )

A. 电池工作时H+移向负极
B. 该电池用的电解质溶液是KOH溶液
C. 甲电极反应式:CO(NH2)2+H2O-6e-=CO2+N2+6H+
D. 电池工作时,理论上每净化1 mol CO(NH2)2,消耗33.6 L O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10molL1的NaOH溶液分别滴定20.00mL浓度均为0.10molL1的CH3COOH溶液和HCN溶液,所得滴定曲线如图所示,下列说法正确的是( )

A. 点①和点②所示溶液中:c(CH3COO)<c(CN)
B. 点④所示溶液中:c(Na+)>c(OH)>c(CH3COO)>c(H+)
C. 点①和点②所示溶液中:c(CH3COO)c(CN)=c(HCN)c(CH3COOH)
D. 点③所示溶液中:c(CH3COO)+c(OH)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。请回答下列问题:

(1)下列说法正确的是__________。
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
(2)将100 mL 1 mol·L-1H2SO4加入100 mL含Ba2+0.137 g的溶液中充分反应后,过滤出沉淀,滤液中残留的Ba2+的物质的量浓度为____________。
(3)将沉淀用100 mL纯水和100 mL 0.01 mol·L-1的H2SO4分别洗涤,两种情况下损失的BaSO4的质量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是

A. 放电时,多孔碳材料电极为负极
B. 放电时,外电路电子由多孔碳材料电极流向锂电极
C. 充电时,电解质溶液中Li+向多孔碳材料区迁移
D. 充电时,电池总反应为Li2O2-x=2Li+(1-![]() )O2
)O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化镁溶液的密度为1.18 g·cm-3,其中镁离子的质量分数为5.1%。300 mL该溶液中氯离子的物质的量约等于( )
A. 0.37 mol B. 0.63 mol C. 0.74 mol D. 1.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
A. A的转化率变大 B. 平衡向正反应方向移动
C. D的体积分数变大 D. a < c+d
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com