
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖(C12H22O11) | 25.00 | 342 |
| 硫酸钾 | 0.84 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.316 | 158 |
| 硝酸银 | 0.075 | 170 |
分析 (1)根据溶液的配制步骤来分析使用的仪器;
(2)根据c=$\frac{n}{V}$判断;
(3)K+来自高锰酸钾、硫酸钾的电离,由n=$\frac{m}{M}$计算高锰酸钾、硫酸钾的物质的量,根据钾离子守恒可知n(K+)=n(KMnO4)+2n(K2SO4),再根据物质的量浓度定义计算钾离子物质的量浓度.
解答 解:(1)根据配制操作可知,因配制1000mL溶液,则需选用1000mL容量瓶,最后需胶头滴管定容,所以所需仪器除托盘天平、烧杯、玻璃棒、药匙外还需胶头滴管、1000mL容量瓶;
故答案为:胶头滴管;1000mL容量瓶;
(2)A.定容时俯视容量瓶刻度线,溶液的体积偏小,则溶液的浓度偏大,故A不选;
B.容量瓶在使用前未干燥,里面有少量蒸馏水,对溶液的浓度无影响,因为定容过程中要加水定容,故B选;
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净,氯化钠与硝酸银反应生成AgCl沉淀,导致硝酸银的浓度减小,故C不选;
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理,对溶液的浓度无影响,故D选.
故答案为:BD;
(3)高锰酸钾的物质的量为n(KMnO4)=$\frac{m}{M}$=$\frac{0.316g}{158g/mol}$=0.002mol.
硫酸钾的物质的量为n(K2SO4)=$\frac{0.84g}{174g/mol}$=0.0048mol,
n(K+)=n(KMnO4)+2n(K2SO4)=0.002mol+2×0.0048mol=0.011655mol,
所以c(K+)=$\frac{0.011655mol}{0.5L}$=0.0233mol/L.
故答案为:0.0233.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大,把握实验原理和实验操作过程是解题的关键,侧重于考查学生的分析能力和实验能力.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:解答题
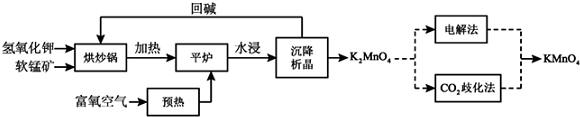
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
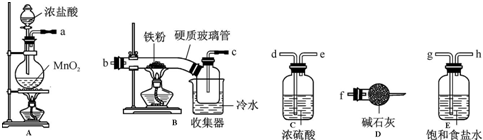
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2$\stackrel{CO_{2}}{→}$CaCO3$\stackrel{高温}{→}$CaO | B. | Fe$\stackrel{少量Cl_{2}}{→}$FeCl2$\stackrel{NaOH溶液}{→}$Fe(OH)2 | ||
| C. | Al2O3$\stackrel{NaOH溶液}{→}$NaAlO2$\stackrel{CO_{2}}{→}$Al(OH)3 | D. | SiO2$\stackrel{水}{→}$H2SiO3$\stackrel{NaOH溶液}{→}$Na2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2与Na2O | B. | Na2O2 | C. | Na2O2与Na | D. | Na和Na2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | c点对应的溶液中大量存在的离子可能为:Na+、H+、Cl-、NO3- | |
| B. | 将25℃时的KCl溶液加热到t℃,则该溶液中的c(OH-)由a点变化到b点 | |
| C. | t℃<25℃ | |
| D. | ac线上的任意一点溶液均有c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
时间s 浓度mol/L | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com