
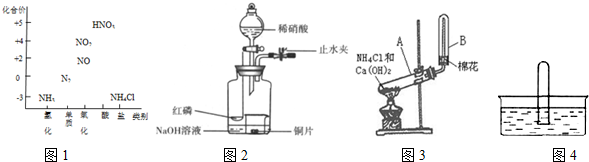
分析 (1)①实验室用固体氯化铵和固体氢氧化钙反应制备氨气;
②依据氨气的物理性质-密度、水溶性选择收集方法;
③依据氨气极易溶于水的性质解答;
④加热固体药品时,试管口应向下倾斜;因产物中有水,且氨气极易溶于水,所以制取干燥的氨气,需干燥装置;
(2)①b.化合价升高的元素体现还原性,氨气催化氧化生成一氧化氮和水,反应中体现氨气的还原性;
②化合价降低的元素体现氧化性,铜与稀硝酸反应生成硝酸铜和一氧化氮和水,反应中硝酸体现强的氧化性;
(3)装置用来制备NO并验证其还原性,先在无氧气操作状态下制得的NO,为了更好的验证一氧化氮气体的还原性,白磷燃烧消耗掉氧气,氢氧化钠吸收空气中的二氧化碳和生成的五氧化二磷,再滴入硝酸和铜反应生成一氧化氮无色气体;验证一氧化氮的还原性可以打开止水夹使空气进入到广口瓶,一氧化氮遇到氧气会被氧化为二氧化氮,据此分析;
(4)①二氧化氮和水反应生成硝酸和一氧化氮;
②NO2与水和氧气按一定比例混合,NO2可完全被水吸收生成硝酸.
解答 解:(1)①铵盐和碱反应生成氨气,实验室用固体氯化铵和固体氢氧化钙反应制备氨气,反应的方程式为:Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
②氨气极易溶于水,所以只能用排空气的方法收集,又因为氨气密度小于空气密度,所以选择向下排空气法收集,
故答案为:氨气密度比空气轻;
③氨气易溶于水,使装置中的压强小于外界的压强,从而引起倒吸,
故答案为:氨水极易溶于水;
④氯化铵和氢氧化钙反应制取氨气有水生成,为防止试管炸裂,且固体药品含有湿存水,所以加热时需试管A管口向下倾斜,即该同学的实验装置中有一个明显的错误是:试管A管口向上倾斜(或试管A管口未向下倾斜),要制取干燥的氨气应对制取的氨气进行干燥,可在发生装置A和收集装置B之间,连接装有碱石灰的干燥管或U形管,
故答案为:试管A管口向上倾斜(或试管A管口未向下倾斜);在发生装置A和收集装置B之间,连接装有碱石灰的干燥管或U形管;
(2)①b.氨气催化氧化生成一氧化氮和水,化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,氨气中-3价N升高为+2价,体现还原性,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O
②铜与稀硝酸反应生成硝酸铜和一氧化氮和水,化学方程式:3Cu+8HNO3 (稀)═3Cu(NO3)2+2NO↑+4H2O,硝酸中+5价N降为+2价,体现氧化性,
故答案为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
(3)滴入稀硝酸之前,应该关闭止水夹,点燃红磷并伸入瓶中,塞好胶塞.这样操作的目的是消除装置中的氧气,滴入稀硝酸后,发生反应为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,现象是:Cu片逐渐溶解,有无色气泡产生,溶液由无色变为蓝色,打开止水夹,通入少量氧气或空气,一氧化氮遇到氧气会被氧化为二氧化氮,可验证NO的还原性,
故答案为:消除装置中的氧气;液变蓝、铜片表面产生无色气体;氧气或空气;
(4)①二氧化氮可以和水之间反应,反应物NO2中N元素化合价降低为+2价,升高为+5价,生成硝酸和一氧化氮,反应为:3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2NHO3+NO;
②NO2与水和氧气反应生成硝酸,发生反应的方程式为:4NO2+O2+2H2O=4HNO3,所以使试管中NO2完全被水吸收的操作是:向试管中通入氧气,
故答案为:向试管中通入氧气.
点评 本题考查氨气的制备原理,氨气的性质,题目难度中等,注意一氧化氮的制备和还原性验证的实验操作分析和实验步骤的设计,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①③④ | C. | ①② | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
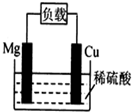
| A. | 电池反应为:Mg+2H+=Mg2++H2↑ | B. | 镁棒发生还原反应 | ||
| C. | 电子从铜棒经外电路流向镁棒 | D. | 铜棒为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,负极质量增加 | |
| B. | 放电时,溶液中的BF4-向正极移动 | |
| C. | 充电时,阳极附近溶液的酸性增强 | |
| D. | 充电时,阴极的电极反应式为Pb2+-2e-═Pb |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是一种国际基本物理量 | |
| B. | 1 mol氢的质量为1g | |
| C. | 在同温同压下,相同体积的任何气体单质所含分子数相同 | |
| D. | 标准状况下气体摩尔体积约为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(CO)=0.03 mol/(L•s) | B. | v(NO2)=0.7 mol/(L•min) | ||
| C. | v(N2)=0.4 mol/(L•min) | D. | v(CO2)=1.1 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-一定不能大量存在于该溶液中 | |
| B. | NH4+一定不能大量存在于该溶液中 | |
| C. | 该溶液的pH一定为12 | |
| D. | 该溶液中c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液是盐溶液 | |
| B. | 该溶液可能是酸或碱溶 | |
| C. | 该溶液中c(OH-)=10-5mol/L | |
| D. | 该溶液与pH=9的氢氧化钠等体积混合,混合后溶液可能呈中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com