
����Ŀ��ij���ε�س䡢�ŵ�Ļ�ѧ����ʽΪ��2K2S2+KI3![]() K2S4+3KI���������豸���ӵĵ�·��ͼʾ�����պϿ���Kʱ��X������Һ�ȱ�죮������˵����ȷ����
K2S4+3KI���������豸���ӵĵ�·��ͼʾ�����պϿ���Kʱ��X������Һ�ȱ�죮������˵����ȷ����
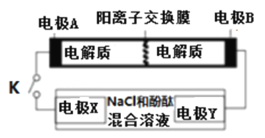
A.K+���ҵ���ͨ�������ӽ���Ĥ
B.A�ĵ缫��ӦʽΪ��3I����2e��=I3��
C.����0.1molK+ͨ�����ӽ���Ĥ��X�缫�ϲ�����״��������1.12L
D.��س��ʱ��B�缫Ҫ�����Դ�������������缫�Ϸ�����ԭ��Ӧ
���𰸡�C
��������
���պϿ���Kʱ��X��������Һ�ȱ�죬�����X��Ϊ�������缫��ӦΪ2H2O+2e-==2OH-+H2������缫YΪ�������缫AΪ�������缫BΪ������
A����ԭ����У��������������ƶ�����K+������ͨ�������ӽ���Ĥ��A����ȷ��
B��A�缫Ϊ�������缫��ӦʽΪ��2S22--2e - = S42-��B����ȷ��
C������0.1molK+ͨ�����ӽ���Ĥʱ����·��ͨ��0.1mole-��X�缫�ϲ�����״��������0.05mol��22.4L/mol=1.12L��C��ȷ��
D����س��ʱ��B�缫��������Ҫ�����Դ�������������缫�Ϸ���������Ӧ��D����ȷ��
��ѡC��


 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������![]() ��Ҫ�����մɡ������ȵ���ɫ���ϣ�Ҳ����������������ء���������֪��
��Ҫ�����մɡ������ȵ���ɫ���ϣ�Ҳ����������������ء���������֪��
��![]() ��ҵ�����ú�������
��ҵ�����ú�������![]() ���������ơ�þ�Ͻ�Ϊ��
���������ơ�þ�Ͻ�Ϊ��![]() ��ȡ������
��ȡ������![]() ���ٸ������ղ�������ȡ������������
���ٸ������ղ�������ȡ������������
��![]() ����ĸơ�þ�����ξ�������ˮ��
����ĸơ�þ�����ξ�������ˮ��
��![]() ��
��![]() ��
��

�������й�������ʾ��ͼ�ش����⡣
![]() ����
����![]() ��������Ҫ��Ӧ�����ӷ���ʽΪ______������
��������Ҫ��Ӧ�����ӷ���ʽΪ______������![]() ��Һ��pH��
��Һ��pH��![]() ����Ŀ��Ϊ______�����������
����Ŀ��Ϊ______�����������![]() ��������Һ��
��������Һ��![]() ______��
______��
![]() ������
������![]() ���ȿ����и�����ˮ���ڸ�����������Сʱ���Ƶ�
���ȿ����и�����ˮ���ڸ�����������Сʱ���Ƶ�![]() ��ͬʱ��û�����塣���������ȷֽ�Ļ�ѧ����ʽΪ______��
��ͬʱ��û�����塣���������ȷֽ�Ļ�ѧ����ʽΪ______��
![]() ��ҵ�ϻ����õ�ⷨ��ȡ
��ҵ�ϻ����õ�ⷨ��ȡ![]() ��NaOH��Һ����
��NaOH��Һ����![]() ��Һ��pH��
��Һ��pH��![]() ����������
����������![]() ����ö��Ե缫��⡣�������в�����
����ö��Ե缫��⡣�������в�����![]() ��
��![]() ������������������
������������������![]() ���ٰѶ���������Ϊ��������
���ٰѶ���������Ϊ��������![]() ����
����![]() ����
����![]() �����ӷ���ʽΪ______��amol������ȫ��ת��Ϊ������ʱ�����·��ͨ�����ӵ����ʵ���Ϊ______��
�����ӷ���ʽΪ______��amol������ȫ��ת��Ϊ������ʱ�����·��ͨ�����ӵ����ʵ���Ϊ______��
![]() �����ɳ�������ִ��������й㷺��Ӧ�ã���䡢�ŵ練Ӧ���̰���ʽ���У�
�����ɳ�������ִ��������й㷺��Ӧ�ã���䡢�ŵ練Ӧ���̰���ʽ���У�![]()
![]()
![]() ��д���õ�س��ʱ�����ĵ缫��Ӧʽ______��
��д���õ�س��ʱ�����ĵ缫��Ӧʽ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Խ��Խ�����ӣ�ij��������Ϊ���ٻ�����Ⱦ�������Դ�������ʡ����ѳ����ȼ���״���������������������Ҫ�����������£�(FeTiO3��TiΪ��4��)
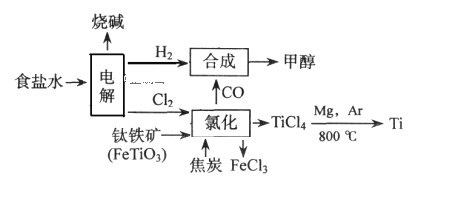
����������ȷ����( )
A.��������ֻ��������������Ȼ����漰������ԭ��Ӧ
B.���ϳ�����Ӧ���������뻹ԭ�������ʵ���֮��Ϊ1��1
C.���Ȼ���ʱ��Ӧ����ʽΪ7Cl2��2FeTiO3��6C��2FeCl3��2TiCl4��6CO(����ʡ��)
D.������������Mg��Ar��������Mg��CO2������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������þ������(H3BO3)������Ҫ�Ļ���ԭ�ϣ��ɲ�����þ��Mg2B2O5��H2O��SiO2������Fe2O3��Al2O3)Ϊԭ�������������������þ���乤��������ͼ��
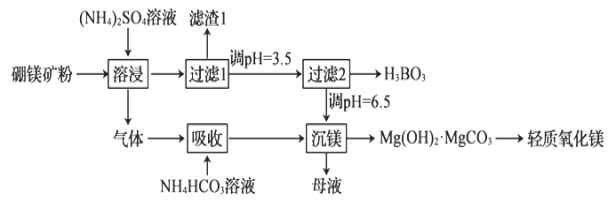
��������������ǣ� ��
A.Fe2O3��Al2O3����������(NH4)2SO4��Һ
B.�����������������е�����ΪNH3
C.��������2��ʱ������Һ�ļ���Խǿ�õ�������Խ��
D.����þ���еõ���ĸҺ�����Ⱥ�ɷ������ܽ�������ѭ��ʹ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��صļ���װ��ͼ������ʾ��a��b��y��x�缫���Ͼ�Ϊ���Ե缫���ֱ��A��B��ͨ���Ҵ���O2���ø�װ�ý���ʵ�飬����˵����ȷ����( )
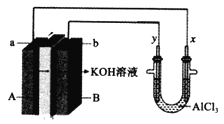
A. a�缫��ӦʽΪC2H5OH+12OH�D�D12e��=2CO2��+9H2O
B. AlCl3��Һ�е��ܷ�ӦΪ2Cl��+2H2O=Cl2��+H2��+2OH��
C. ��Ӧ��ʼ�۲쵽x�缫�������ְ�ɫ����
D. �����ÿͨ��32gO2���Ҳ���ع�����2mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴ӦmA(g)![]() nB(g)��pC(s)����H��Q���¶Ⱥ�ѹǿ�ı仯�������淴Ӧ���ʵ�Ӱ��ֱ������ͼ�е�����ͼ������������ȷ����
nB(g)��pC(s)����H��Q���¶Ⱥ�ѹǿ�ı仯�������淴Ӧ���ʵ�Ӱ��ֱ������ͼ�е�����ͼ������������ȷ����
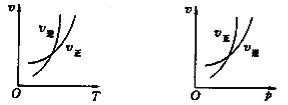
A. m>n��Q>0 B. m>n��p��Q>0 C. m<n��p��Q<0 D. m>n��Q<0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ���õ绯ѧ���������л���ˮ��ԭ��ʾ��ͼ������˵����ȷ����
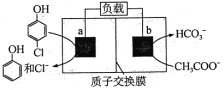
A. a��b������ʹ��ͬ�ֵ缫����
B. ����ʱ��a���ĵ��Ƶ���b���ĵ���
C. ����һ��ʱ��֮��a������Һ��pH����
D. b���ĵ缫��ӦʽΪ��CH3 COO��+4H2O��8e��=2HCO3��+9H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A.�����£�ϡ��![]() �İ�ˮ����Һ��
�İ�ˮ����Һ��![]() ��
��![]() ��
��![]() ���½�
���½�
B.![]() ��
��![]() ��Һ��
��Һ��![]()
C.�����£�![]() ��ȵ�
��ȵ�![]() ��Һ�У��������ʵ���Ũ�ȴ�С��ϵ��
��Һ�У��������ʵ���Ũ�ȴ�С��ϵ��![]()
D.����Һ�д��ڵ�����ֻ��![]() ��
��![]() ��
��![]() ��
��![]() ʱ������Һ������Ũ�ȴ�С��ϵ����Ϊ
ʱ������Һ������Ũ�ȴ�С��ϵ����Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£�ˮ��Һ��H����Ũ�ȱ仯������ͼ��ʾ������˵����ȷ���ǣ�������
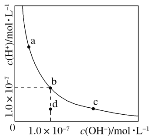
A.�����¶ȣ�����������c��b�ı仯
B.���¶��£�ˮ�����ӻ�����Ϊ1.0��10��13
C.���¶��£�����FeCl3����������b��a�ı仯
D.���¶��£�ϡ����Һ����������c��d�ı仯
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com