

分析 【交流讨论】酸碱中和反应生成盐和水,加指示剂判断滴定终点;
【探究实验】张南同学的实验:镁离子与碱反应生成白色沉淀,上层清液中硫酸根离子与钡离子结合生成硫酸钡沉淀;
小岗同学的实验:若出现蓝色沉淀为氢氧化铜,若加氯化钡生成白色沉淀,可知含硫酸钠;
【反思与总结】不仅所加试剂与被检验物质能发生反应,还需要考虑所加试剂不能引入被检测的物质.
解答 解:【交流讨论】对小岗同学的方案进行评价为不可以,未滴加指示剂,无法判断NaOH是否与HCl发生反应.由此得出结论,用化学实验的方法验证物质的存在,不仅所加试剂与被检验物质能发生化学反应,还需要能够检测出反应是否发生,才能验证物质的存在,
故答案为:不可以,未滴加指示剂,无法判断NaOH是否与HCl发生反应;能够检测出反应是否发生;
【探究实验】张南同学的实验:重新取溶液样品少许于试管中,向其中滴加足最MgSO4溶液,出现白色沉淀后,取上层清液,再滴加BaCl2溶液,又出现白色沉淀,确定溶液中溶质含NaOH和Na2SO4,对张南同学的实验及结论进行评价为不能得出结论,因为不严谨,加入的MgSO4溶液也有硫酸根,无法判断检测到的硫酸根是后加入的还是最开始样品中就有的;小岗同学的实验:重新取溶液样品少许于试管中,其中滴加足量Cu(NO3)2溶液,出现蓝色沉淀后,确定溶液中溶质含NaOH,反应的化学方程式为Cu(NO3)2+2NaOH=2NaNO3+Cu(OH)2↓;待上述沉淀完全后,取上层清液,再滴加BaCl2溶液,出现白色沉淀,可确定溶液中溶质含Na2SO4,
故答案为:不能得出结论,因为不严谨,加入的MgSO4溶液也有硫酸根,无法判断检测到的硫酸根是后加入的还是最开始样品中就有的;蓝色沉淀;Cu(NO3)2+2NaOH=2NaNO3+Cu(OH)2↓;BaCl2;
【反思与总结】由此得出结论,用化学实验的方法验证同一溶液中两种物质的存在,不仅所加试剂与被检验物质能发生反应,还需要考虑所加试剂不引入被检测物质,才能验证这两种物质的存在,故答案为:不引入被检测物质.
点评 本题考查探究物质的组成实验,为高频考点,把握发生的反应、现象及实验技能为解答的关键,侧重分析与实验能力的考查,注意检验时不能引入被检验的物质,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 142g氯气中含Cl2的分子数为2NA | |
| B. | 1.7gOH-中所含电子的数目为NA | |
| C. | 49g硫酸中所含氧原子的数目为2NA | |
| D. | 71g硫酸钠中所含钠离子的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 如图为A物质的溶解度曲线.M、N两点分别表示A物质的两种溶液.下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水,步骤中的过滤操作均未写出)( )
如图为A物质的溶解度曲线.M、N两点分别表示A物质的两种溶液.下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水,步骤中的过滤操作均未写出)( )| A. | 从N→M:先向N中加入适量固体A再降温 | |
| B. | 从N→M:先将N降温再加入适量固体A | |
| C. | 从M→N:先将M降温再将其升温 | |
| D. | 从M→N:先将M升温再将其蒸发掉部分水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
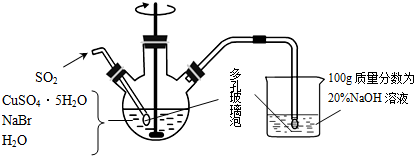
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 原子半径:r(W)>r(Z)>r(Y) | |
| B. | 含Y元素的盐溶液一定显酸性 | |
| C. | 最高价氧化物对应水化物的酸性:Z>W | |
| D. | X、W分别形成的简单气态氢化物可反应生成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

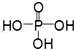 )
)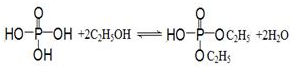 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价氧化物水化物的碱性:Y<Z | B. | 简单气态氢化物的热稳定性:X<W | ||
| C. | 简单气态氢化物的沸点:X<W | D. | 简单离子的还原性:X<W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酸性KMnO4溶液能鉴别CH3CH═CHCH2OH和CH3CH2CH2CHO | |
| B. | 乙酸乙酯能水解,可用于制备肥皂 | |
| C. | 根据核磁共振氢谱不能鉴别1-溴丙烷和2-溴丙烷 | |
| D. | 食用花生油和鸡蛋清都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等.
氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等. D.相同压强时,NH3沸点比PH3高
D.相同压强时,NH3沸点比PH3高查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com