
| A. | 3,4-二甲基戊烷 | B. | 2,3-二甲基丁烷 | ||
| C. | 2,2-二甲基丁烷 | D. | 2,2,3,3-四甲基丁烷 |
分析 烷烃命名原则:
①长-----选最长碳链为主链;
②多-----遇等长碳链时,支链最多为主链;
③近-----离支链最近一端编号;
④小-----支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简-----两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面.
解答 解:A、3,4-二甲基戊烷不是从离支链最近一端编号,应该为2,3-二甲基戊烷,故A错误;
B、2,3-二甲基丁烷,符合烷烃的命名原则,故B正确;
C、2,2-二甲基丁烷,符合烷烃的命名原则,故C正确;
D、2,2,3,3-四甲基丁烷符合烷烃的命名原则,故D正确;
故选A.
点评 本题考查了有机物的命名,题目难度不大,该题注重了基础性试题的考查,侧重.对学生基础知识的检验和训练,该题的关键是明确有机物的命名原则,然后结合有机物的结构简式灵活运用即可,有利于培养学生的规范答题能力.


科目:高中化学 来源: 题型:解答题
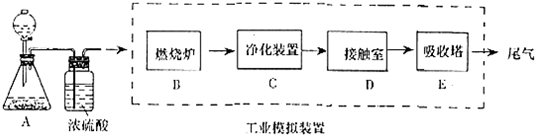

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
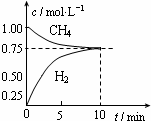 工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g);△H=+206kJ/mol,一定条件下向体积为1L的密闭容器中充入1mol CH4和1mol H2O,测得CH4(g)和CO(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )
工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g);△H=+206kJ/mol,一定条件下向体积为1L的密闭容器中充入1mol CH4和1mol H2O,测得CH4(g)和CO(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )| A. | 10min时用CH4表示的反应速率为0.075 mol•L-1•min-1 | |
| B. | 使用高效催化剂能够增大CO的产率 | |
| C. | 该条件下反应的平衡常数为0.1875 | |
| D. | 升高温度能使$\frac{c(C{H}_{4})}{c(CO)}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
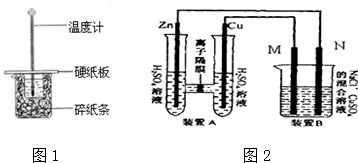
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
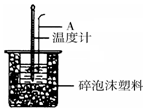 50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置 中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.
50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置 中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜屑加入Fe3+溶液中:2Fe3++Cu═2Fe2++Cu2+ | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| C. | 氯化亚铁溶液中通入氯气:Fe2++Cl2═Fe3++2Cl- | |
| D. | 将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫原子的原子结构示意图: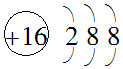 | |
| B. | NH4Cl的电子式: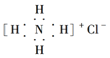 | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| D. | HBr的形成过程: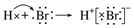 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com