
NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得.操作步骤如图:
(1)加Na2S的目的是除去铜、锌等杂质,请写出除去Cu2+的离子方程式 :
(2)加6%的H2O2时,温度不能过高,其目的是
(3)除铁方法:用H2O2充分氧化后,再用NaOH控制pH值2~4范围内生成氢氧化铁沉淀.在上述方法中,氧化剂可用NaClO3代替,请写出用氯酸钠氧化Fe2+的离子方程式为
(4)上述流程中滤液Ⅲ的主要成分是
(5)操作Ⅰ包括以下过程:过滤,溶解, , ,洗涤获得NiSO4•6H2O晶体
【知识点】工艺流程题 B1 B3 J1
【答案解析】(1)S2-+Cu2+===CuS↓
(2)减少(防止)过氧化氢的分解
(3)6Fe2++ ClO3-+6H+===6Fe3++Cl-+3H2O
(4))Na2SO4、NiSO4
(5)蒸发浓缩 冷却结晶
解析:⑴Na2S与Cu2+反应生成沉淀:S2-+Cu2+===CuS↓
⑵H2O2温度过高会发生分解
⑶氯酸钠将Fe2+氧化为Fe3+,本身被还原为Cl-,根据得失电子相等Fe2+与 ClO3-的物质的量之比为6:1.
⑷从整个流程看引入了钠离子,SO42-,除去了最后Cu、Zn、Fe、Cr等杂质,得到NiSO4•6H2O,因此滤液Ⅲ的主要成分是Na2SO4、NiSO4
⑸根据洗涤后获得NiSO4•6H2O,则之前的操作是蒸发浓缩 冷却结晶
【思路点拨】对于结晶水合物的析出一般是采取蒸发浓缩、冷却结晶的方法;流程中发生的化学变化则可根据流程中所加的物质及原料的成分判断。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极。
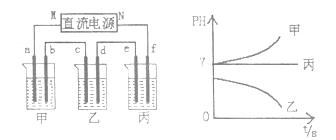
接通电源,经过一端时间后,测得乙中c电极质量增加了27克。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的 极(填写“正”或“负”),甲、乙电解质分别为 、 (填写化学式)。
(2)要使电解后丙中溶液恢复到原来的状态,应加入 物质。(填写化学式)
(3) 若电解后甲溶液的体积为25L,且产生的气体全部逸出。该溶液常温时的pH为 。
(4)写出乙烧杯中发生反应的离子方程式
(5)写出甲烧杯中发生反应的离子方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在指定溶液中一定能大量共存的是
①透明溶液中:K+、Fe3+、MnO4-、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、Br-、SO42-、NH4+
④由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ca2+、Cl-、Br-
⑤有较多Fe3+的溶液中: Na+、NH4+、Cl-、HCO3-
⑥酸性溶液中:Fe2+、Al3+、NO3-、Cl-
A.①② B.③⑥ C.②④ D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式是
A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
B.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+4H2O
C.磁性氧化铁溶于稀硝酸:Fe3O4+8H+=Fe2++2Fe3++4H2O
D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:
2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X中仅含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:
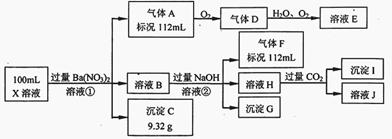
根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是_____________。
若要用实验证明该阴离子是否存在,最可靠的化学方法是_____________。
(2)尽量用离子方程表达下列反应:
①中生成气体A:_____________。
②中生成溶液H:_____________。
③中产生的气体F遇氯气产生白烟:_____________。
(3)若②中所用氢氧化钠浓度为2mol/L,当加入l0 ml时开始产生沉淀,55 ml时沉淀的量达到最大值0.03 mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60ml时沉淀的量降为0.025 mol且保持不变,则原溶液中c(Fe2+)为___________mol/L、c(Fe3+)为___________mol/L、c(Cl-)为___________mol/L。(若有些离子不存在,请填0 mol/L)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质的检验方法正确的是( )
A.向某无色溶液中滴加氯化钡溶液,产生白色沉淀,再加入稀盐酸后该沉淀不溶解,说明原溶液中一定含有SO42-离子
B.向某混有KI杂质的溶液中加入足量FeCl3溶液,用CCl4萃取,在无色的水层中加入氯水,溶液呈橙黄色,则该溶液中含有Br-
C.向某白色固体粉末中滴加稀盐酸,产生使澄清石灰水变浑浊的气体,则原固体粉末中一定含有CO32-或者HCO3-离子
D.某溶液能使淀粉碘化钾溶液变蓝,则该溶液一定为氯水或者溴水
查看答案和解析>>
科目:高中化学 来源: 题型:
下图为苯和溴的取代反应的实验装置图,其中A为由具有支管的试管制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑粉。
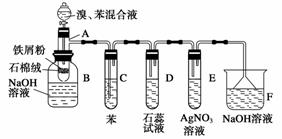
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):_________________________________________。
(2)试管C中苯的作用是__________________。反应开始后,观察D和E两试管,看到的现象为________________________________________________________________________。
(3)反应2~3 min后,在B中的NaOH溶液里可观察到的现象是
________________________________________________________________________。
(4)在上述整套装置中,具有防倒吸作用的仪器有________(填字母)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com