C
分析:对KOH和K
2CO
3混合配成的溶液,当滴加盐酸时,先发生氢氧化钾与盐酸的中和反应,再发生碳酸钾与盐酸的反应生成碳酸氢钾和氯化钾,最后发生碳酸氢钾与盐酸反应才有二氧化碳气体生成,利用物质的量的关系并结合图象即可解答.
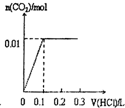
解答:0.56克KOH的物质的量为
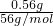
=0.01mol,1.38克K
2CO
3的物质的量为

=0.01mol,KOH和K
2CO
3混合配成的溶液,当滴加盐酸时,先发生氢氧化钾与盐酸的中和反应,再发生碳酸钾与盐酸的反应生成碳酸氢钾和氯化钾,最后发生碳酸氢钾与盐酸反应才有二氧化碳气体生成,
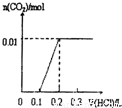
A、加入0.1L盐酸,n(HCl)=0.1L×0.1mol/L=0.01mol,0.01mol盐酸与氢氧化钾反应没有气体生成,再加入0.01molHCl,与0.01mol碳酸钾恰好反应生成碳酸氢钾,也没有气体生成,则图象与实际不符,故A错误;
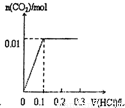
B、先发生氢氧化钾与盐酸的中和反应,图象中开始反应即有气体生成,与反应不符,故B错误;
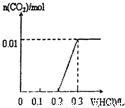
C、向KOH和K
2CO
3混合溶液中滴加盐酸时,首先和KOH反应生成水和氯化钾,当滴入0.1L时,两者恰好反应完全;继续滴加时,盐酸和K
2CO
3开始反应,首先发生HCl+K
2CO
3=KHCO
3+KCl,不放出气体,当再加入0.1L时,此步反应进行完全;继续滴加时,发生反应:KHCO
3+HCl=KCl+H
2O+CO
2↑,此时开始放出气体,再消耗0.1L盐酸,生成二氧化碳达最大,图象与实际相符合,故C正确;
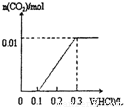
D、因碳酸钾与盐酸的反应分步完成,则碳酸钾与盐酸先反应生成碳酸氢钾和氯化钾,此时没有气体生成,则图象与反应不符,故D错误;
故选C.
点评:此题考查了元素化合物性质、图象计算等,解答此题关键是明确向碳酸钠溶液中滴加盐酸的反应是分步进行的,首先发生的是HCl+K
2CO
3=KHCO
3+KCl;进行完全后,再发生:KHCO
3+HCl=KCl+H
2O+CO
2↑.




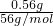 =0.01mol,1.38克K2CO3的物质的量为
=0.01mol,1.38克K2CO3的物质的量为 =0.01mol,KOH和K2CO3混合配成的溶液,当滴加盐酸时,先发生氢氧化钾与盐酸的中和反应,再发生碳酸钾与盐酸的反应生成碳酸氢钾和氯化钾,最后发生碳酸氢钾与盐酸反应才有二氧化碳气体生成,
=0.01mol,KOH和K2CO3混合配成的溶液,当滴加盐酸时,先发生氢氧化钾与盐酸的中和反应,再发生碳酸钾与盐酸的反应生成碳酸氢钾和氯化钾,最后发生碳酸氢钾与盐酸反应才有二氧化碳气体生成,