
| A. | CH3Cl  | B. | 乙烯的结构简式 CH2CH2 | ||
| C. | 淀粉的化学式为(C6H10O5)n | D. | H2O2的电子式: |
分析 A.氯原子最外层达到8电子稳定结构,漏掉了氯原子的3对未成键电子;
B.乙烯的结构简式中没有标出碳碳双键;
C.淀粉为高分子化合物,淀粉的化学式为(C6H10O5)n;
D.双氧水为共价化合物,电子式中不存在阴阳离子.
解答 解:A.CH3Cl为共价化合物,C、Cl原子最外层都达到8电子稳定结构,其正确的电子式为: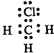 ,故A错误;
,故A错误;
B.乙烯分子中含有碳碳双键,乙烯正确的结构简式为:CH2=CH2,故B错误;
C.淀粉属于天然高分子化合物,其化学式为(C6H10O5)n,故C正确;
D.双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水正确的电子式为: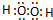 ,故D错误;
,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、化学式、结构简式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的分析能力及规范答题能力.


科目:高中化学 来源: 题型:选择题
| A. | 光气(COCl2) | B. | 六氟化硫(SF6) | C. | 三氟化硼(BF3) | D. | 五氯化磷(PCl5) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
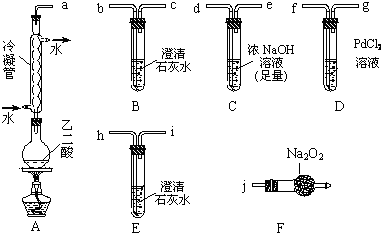
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应①为取代反应,有机产物与水混合浮在上层 | |
| B. | 反应②为氧化反应,反应现象是火焰明亮并带有浓烟 | |
| C. | 反应③为取代反应,浓硫酸是反应物 | |
| D. | 反应④中1 mol苯最多与3 mol H2发生加成反应,是因为苯分子含有三个碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据如图原电池的装置图回答下列问题:
根据如图原电池的装置图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子中含有3种官能团 | B. | 可发生加成、取代、水解反应 | ||
| C. | 分子式为C7H6O5 | D. | 水溶液中羧基和羟基均能电离出H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
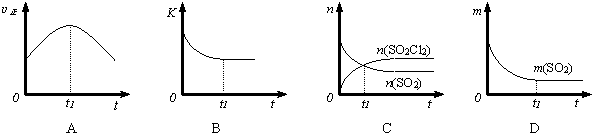
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com