
【题目】通常用来衡量一个国家石油化工发展水平的标志是
A. 石油的产量B. 乙烯的产量
C. 塑料的产量D. 合成纤维的产量
科目:高中化学 来源: 题型:
【题目】将两份质量相同的铝,分别投入足量的稀硫酸和氢氧化钠溶液中,充分反应后产生氢气的质量
A.与稀硫酸产生氢气多B.与氢氧化钠产生氢气多
C.一样多D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙烯和乙烷相比较的说法中,不正确的是
A. 乙烯属于不饱和烃,乙烷属于饱和烃
B. 乙烯和乙烷互为同系物
C. 乙烷在光照条件下能与Cl2发生取代反应,乙烯则不能
D. 乙烯能使Br2的CCl4溶液褪色,乙烷则不能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和水处理剂。以氯酸钠为原料制备亚氯酸钠的装置如下图所示(夹持装置省略)。

已知:
①纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全。
②NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O;高于38℃时析出NaClO2;高于60℃时NaClO2分解成NaClO3和NaCl。
(1)检查A装置气密性的方法是____________________________________。该装置中产生ClO2的化学方程式为_________________________________________。
(2)实验过程中需要持续通入空气,目的是_________________________________。
(3)NaClO2在碱性溶液中才能稳定存在,下列可用于检测三颈瓶中溶液酸碱性的是________(填代号)。
a.石蕊 b.酚酞 c.pH试纸 d.pH计
(4)B装置中发生反应的离子方程式为______________________________________;使用冰水浴的原因是_________________________________;反应结束后,从溶液中得到NaClO2固体的实验操作是____________________________________________________。
(5)NaClO2是一种高效水处理剂,在一定条件下可以将CN-氧化成两种无毒无害的气体。现用NaClO2处理10m3含CN-a mg·L-1的工业污水,理论上至少需要NaClO2的质量是___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元弱碱B(OH)2(K1=5.9×10-2、K2=6.4×10-5)。向10mL稀B(OH)2溶液中滴加等浓度盐酸溶液,B(OH)2、B(OH)+、B2+的浓度分数δ随溶液POH[POH=-lgc(OH)-]变化的关系如图,以下说法正确的是
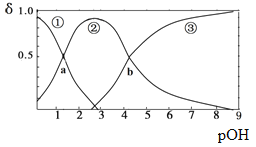
A. 交点a处对应加入的盐酸溶液的体积为5mL
B. 当加入的盐酸溶液的体积为10mL时存在c(Cl-)>c(B(OH)+)>c(H+)>c(OH-)>c(B2+)
C. 交点b处c(OH)=6.4×10-5
D. 当加入的盐酸溶液的体积为15mL时存在:c(Cl-)+c(OH-)= c(B2+)+c(B(OH)+)+ c(H+),
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某金属A及其化合物之间有如下的转化关系:
(1)写出A、B的化学式:A_______,B_________。
(2)写出B→D的化学方程式_______________________________。
(3)写出B→C的离子方程式________________________________。
(4)写出E→C的化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.0mL于锥形瓶中,加入10.0mL的KI溶液(足量),发生的反应为:Cl2+2KI=2KC1+I2,滴入指示剂2~3滴。
②取碱式滴定管依次用自来水、蒸馏水洗净后,马上注入0.01mol/LNa2S2O3溶液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+2Na2S4O6.试回答下列问题:
(1)步骤①加入的指示剂是____________。
(2)判断达到滴定终点的实验现象是____________。
(3)假设未描述的事项都规范合理,则该测定结果将_______(填“偏高”、“偏低”或“无影响”)。
(4)碳酸H2CO3,K1=4.3×10-7,K2=5.6×10-11,草酸H2C2O4,K1=5.9X10-2,K2=6.4×10-5。0.1mol/LNa2CO3溶液的pH____0.1mol/L Na2C2O4溶液的pH。(选填“大于”、“小于”或“等于”)。若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是________。(选填编号)
A. c(H+)>c(HC2O4-)>c(HCO3-)>c(CO32-) B. c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
C. c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-) D. c(H2CO3)>c(HCO3-)>c(HC2O4-)>c(CO32-)
(5) 已知: ①难溶电解质的溶度积常数: Ksp(CaF2)=1.5×10-10②25℃时,2.0×10-3mol/L氢氟酸水溶液中,调节溶液pH (忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示,请根据以下信息回答下列问题:

①25℃时,HF电离平衡常数的数值Ka≈________。
②4.0×10-3mo1/LHF溶液与4.0×10-4mo1/L CaCl2液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),请通过列式计算说明是否有沉淀产生:_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com