
【题目】一定量的![]() 与足量的碳在体积可变的恒压密闭容器中反应:
与足量的碳在体积可变的恒压密闭容器中反应:![]() ,平衡时,体系中气体体积分数与温度的关系如图所示,下列说法正确的是
,平衡时,体系中气体体积分数与温度的关系如图所示,下列说法正确的是
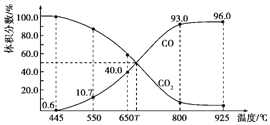
A.![]() 时,若充入惰性气体,
时,若充入惰性气体,![]() 、
、![]() 逆均减小,平衡不移动
逆均减小,平衡不移动
B.![]() 时,反应达平衡后
时,反应达平衡后![]() 的转化率为
的转化率为![]()
C.![]() 时,若充入等体积的
时,若充入等体积的![]() 和CO,平衡向逆反应方向移动
和CO,平衡向逆反应方向移动
D.平衡常数的关系:![]()
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是 ( )
A. 水电离的![]() =1×10-13mol/L的溶液:K+、Na+、AlO2—、CO32—
=1×10-13mol/L的溶液:K+、Na+、AlO2—、CO32—
B. ![]() =1×10-12mol/L的溶液中:Cu2+、NH4+、Cl-、NO3-
=1×10-12mol/L的溶液中:Cu2+、NH4+、Cl-、NO3-
C. 与Al反应能放出H2的溶液:Cu2+、NO3—、K+、SO42—
D. 无色溶液中:Cr2O72—、Na+、H+、SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:① CH3CH=CHCH2CH3![]() CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
② R-CH=CH2![]() R-CH2-CH2-Br
R-CH2-CH2-Br
香豆素的核心结构是芳香内酯A,A经下列步骤转变为水杨酸。

请回答下列问题:
(1)下列有关A、B、C的叙述中不正确的是___________
a. C中核磁共振氢谱共有8种峰
b. A、B、C均可发生加聚反应
c. 1mol A最多能和5mol氢气发生加成反应
d. B能与浓溴水发生取代反应
(2)B分子中有2个含氧官能团,分别为______和______(填官能团名称),B→C的反应类型为_____________。
(3)在上述转化过程中,反应步骤B→C的目的是_________________________。
(4)化合物D有多种同分异构体,其中一类同分异构体是苯的对二取代物,且水解后生成的产物之一能发生银镜反应。请写出其中一种的结构简式:_____________。
(5)写出合成高分子化合物E的化学反应方程式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,10mL 0.40 mol·L-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 3 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是( )(溶液体积变化忽略不计)
A. 反应至6min时,H2O2分解了50%
B. 反应至6min时,c(H2O2)=0.20 mol·L-1
C. 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L·min)
D. 4~6min的平均反应速率:v(H2O2)>3.3×10-2mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在最新的家用汽车的调查中发现,新车中气体的质量不符合标准。汽车污染主要来源于汽车配件及材料,它们都会产生大量的有毒有机物。其中一种有毒物质为A,为了测定有机物A的结构,做如下实验:
①将9.2g该有机物完全燃烧,生成标况下15.68L的CO2和7.2g水;
②用质谱仪测定其相对分子质量,得如图一所示的质谱图;

(1)则由图可知该分子的相对分子质量是___,有机物A的分子式为____。
(2)用核磁共振仪处理该化合物得到四个峰,且面积之比是1∶2∶2:3,则有机物的名称为___,其苯环上的一氯代物有___种。若将有机物A与氢气完全加成,则加成后的有机物的一氯代物共有___种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ToC时,在一固定容积的密闭容器中发生反应:A(g)+B(g)![]() X(s) H < 0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,则判断正确的是
X(s) H < 0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,则判断正确的是
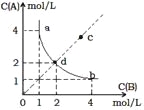
A.ToC时,该反应的平衡常数值为4
B.c点没有达到平衡,此时反应向逆向进行
C.若c点为平衡点,则此时容器内的温度高于ToC
D.ToC时,在d点加入一定量X可达到c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究浓度对化学平衡的影响,某同学进行如下实验:下列说法不正确的是:

A.该实验通过观察颜色变化以判断生成物浓度的变化
B.观察到现象a比现象b中红色更深,即可证明增加反应物浓度,平衡正向移动
C.进行II、III对比实验的主要目的是防止由于溶液体积变化引起各离子浓度变化而干扰实验结论得出
D.若I中加入KSCN溶液的体积改为2mL也可以达到实验目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国具有丰富的铜矿资源,请回答下列有关铜及其化合物的问题:
(1)请写出基态Cu原子的价电子排布式_________。焰火中的绿色是铜的焰色,基态铜原子在灼烧时价电子发生了_________ 而变为激发态。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Il(Zn)______ Il(Cu)(填“大于”或“小于”),原因是___________。
(3)新型农药松脂酸铜具有低残留的特点,下图是松脂酸铜的结构简式:

请分析1个松脂酸铜中π键的个数___________加“*”碳原子的杂化方式为_____________。
(4)硫酸铜溶于氨水形成![]() 4深蓝色溶液。
4深蓝色溶液。
① ![]() 中阴离子的立体构型是_______。
中阴离子的立体构型是_______。
②在![]() 中
中![]() 之间形成的化学键称为_____,提供孤电子对的成键原子是_______________________。
之间形成的化学键称为_____,提供孤电子对的成键原子是_______________________。
③氨的沸点_________________(填“高于”或“低于”)膦;
(5)黄铜合金可以表示为![]() ,为面心立方晶胞,晶体密度为8.5
,为面心立方晶胞,晶体密度为8.5![]() ,求晶胞的边长___________(只写计算式,不求结果)
,求晶胞的边长___________(只写计算式,不求结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图曲线表示其他条件一定时,2NO(g)+O2(g)![]() 2NO2(g) △H<0反应中NO2的百分含量与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )
2NO2(g) △H<0反应中NO2的百分含量与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )
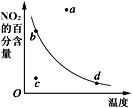
A. a点B. b点C. c点D. d点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com