
| A. | 溶液质量减轻 | |
| B. | Fe3+的氧化性大于Cu2+ | |
| C. | 溶液中Cu2+与Fe2+的物质的量比为1:1 | |
| D. | 1 mol Fe可还原2 mol Fe3+ |
分析 根据金属活动顺序表可知氧化性:Zn2+<Cu2+<Ag+,且存在Cu2+<Fe3+<Ag+,充分搅拌后Fe完全反应,且Fe3+和Ag+完全反应:2Ag++Fe═Fe2++2Ag,2Fe3++Fe═3Fe2+,
A.加入0.1molFe,析出0.1molAg,析出固体的质量大于溶解金属的质量,则溶液质量减小;
B.金属活动顺序表中,排在后面的金属离子氧化性越强;金属铜和三价铁反应生成氯化铜和氯化亚铁,氧化剂的氧化性强于氧化产物的氧化性;
C.加入的0.1mol优先与银离子、铁离子反应,铁离子不参与反应,据此进行计算;
D.根据氧化还原反应中的电子守恒分析.
解答 解:A.0.1mol铁的质量为5.6g,0.1mol银的质量为10.8g,则溶液质量增加了5.6g,减少了10.6g,最终导致溶液质量减轻,故A正确;
B.根据金属活动顺序表可知氧化性:Zn2+<Cu2+<Ag+,金属铜能够和三价铁离子反应生成氯化铜和氯化亚铁,则氧化性Cu2+<Fe3+,故B正确;
C.氧化性Cu2+<Ag+,Fe先还原Ag+,然后还原铁离子;由反应2Ag++Fe═Fe2++2Ag,2Fe3++Fe═3Fe2+可知,反应后总共生成0.2molFe2+,而0.1molCu2+没有参加反应,则反应后溶液中Cu2+与Fe2+的物质的量之比为1:2,故C错误;
D.1molFe转移2mol的电子,而1molFe3+得到1mol的电子,所以可还原2molFe3+,故D正确;
故选C.
点评 本题考查混合物反应的计算与判断,为高频考点,题目难度中等,正确把握物质的氧化性的强弱为解答该题的关键,结合反应的方程式解答该题,试题侧重于学生的分析能力和计算能力的考查.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 被氧化的物质是氧化剂 | |
| B. | 失去电子,化合价降低的物质是还原剂 | |
| C. | 还原剂被还原,氧化剂被氧化 | |
| D. | 得到电子,化合价降低的反应物是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1NA个氢气分子所占的体积为22.4 L | |
| B. | 2NA个二氧化碳分子的质量为88 g | |
| C. | 0.1 mol/L 的NaCl溶液中,Na+与Cl-离子总数为0.2NA | |
| D. | 17 g NH3中所含原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | 单质在自然界中硬度最大 |
| B | 原子中s能级与p能级电子数相等且有单电子 |
| C | C在B的下一周期,C的电离能数据(kJ•mol-1)为:I1=738I2=1451I3=7732I4=10540 |
| D | 单质密度小,较好的延展性,广泛用于食品包装,D的氧化物是两性氧化物 |
| E | 单质是一种常见金属,与B元素能形成黑色和砖红色两种氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制银氨溶液:在一定量氨水溶液中,滴加AgNO3至沉淀恰好溶解 | |
| B. | 配制Cu(OH)2悬浊液:在一定量CuSO4溶液中,加入少量NaOH溶液 | |
| C. | 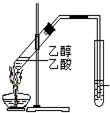 制备乙酸乙酯:用如图所示的实验装置 制备乙酸乙酯:用如图所示的实验装置 | |
| D. | 鉴别环己烯和苯:将溴的四氯化碳溶液分别滴加到少量环己烯和苯中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯是无色无味的液态径,不易燃烧 | |
| B. | 苯与浓硝酸、浓硫酸混合共热可制取硝基苯 | |
| C. | 溴水能与苯发生加成反应而褪色 | |
| D. | 在一定条件下苯与氢气反应制取环己烷,说明苯分子结构中有碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氯化氢能使湿润的蓝色石蕊试纸变为红色,是因为HCl分子中含有H+ | |
| B. | 氯化氢极易溶于水,常温常压下1体积水可溶解500体积HCl | |
| C. | 氯化氢可以用向上排空气法收集 | |
| D. | 氯化氢和盐酸的化学式都是HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com