
能说明反应N2+3H2 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
A.1个N≡N键断裂的同时,有3个H-H键形成
B.1个N≡N键断裂的同时,有3个H-H键断裂
C.1个N≡N键断裂的同时,有2个N-H键断裂
D.1个N≡N键断裂的同时,有6个N-H键形成
科目:高中化学 来源:2016-2017学年湖南省娄底市等五校高二上期中化学卷(解析版) 题型:选择题
下列说法不正确的是( )
A.两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物
B.常温下,浓度均为0.1mol/L①醋酸、②盐酸、③醋酸钠溶液,水电离程度的顺序为③>①>②
C.常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为酸性
D.物质的浓度相同的①氯化铵溶液、②硫酸铵溶液、③碳酸氢铵溶液,pH的顺序为:③>①>②
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林两省八校高一上学期期中化学试卷(解析版) 题型:实验题
KC1样品中含有少量K2CO3、K2SO4和不溶于水的杂质,为了提纯KC1,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作:
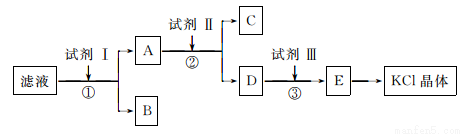
回答下列问题:
(1)为检验起始滤液中的Cl-,所用试剂除了稀硝酸,还需要_____________溶液。
(2)试剂I的化学式为________________,判断试剂I已加过量的方法是_____________。
(3)试剂Ⅱ的化学式为__________________,②中加入试剂Ⅱ的目的是__________________。
(4)试剂Ⅲ的名称是__________,③中发生反应的离子方程式为________________。
(5)某同学根据最终所得KC1晶体质量和原样品的质量计算出氯化钾样品的纯度,你认为结果可靠吗?并说明理由(不考虑实验误差):__________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林两省八校高二上学期期中化学试卷(解析版) 题型:填空题
现有25℃时pH=12的NaOH溶液100 ml。,欲用以下几种方法将其pH调整到11,回答下列问题(已知混合后溶液的总体积等于混合前两稀溶液的体积之和):
(1)25℃时,pH=12的NaOH溶液中由水电离产生的c(OH-)=_________。
(2)加水稀释,需加水的体积为_________mL。
(3)加入pH=2的盐酸,需加盐酸的体积为_________mL。(精确到0.1)。
(4)加入pH=10的NaOH溶液,需加NaOH溶液的体积为________mL。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林两省八校高二上学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.生成物的总能量大于反应物的总能量时,△H<0
B.在其他条件不变的情况下,使用催化剂可以改变反应方向
C.△H<0、△S>0的反应在低温时不能自发进行
D.一个化学反应的△H只与反应体系的始态和终态有关,而与反应的途径无关
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林两省八校高二上学期期中化学试卷(解析版) 题型:选择题
常温下,用水稀释0.1 mol.L-l CH3COOH溶液时,溶液中随着水量的增加而减小的是( )
A.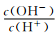 B.
B. C.c(H+).c(OH-) D.OH-的物质的量
C.c(H+).c(OH-) D.OH-的物质的量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高一上期中化学卷(解析版) 题型:填空题
(1)14.2gC12含_________个氯气分子,_______摩尔氯原子,标准状况下所占的体积为________升,与这些Cl2分子数相同H2的质量是__________g,它们恰好完全反应后得到的氯化氢气体的物质的量是________摩尔,质量为________g,在标准状况下是_______升,将产生的氯化氢气体溶于490.4 mL水中,则所得溶液的质量为________g,若所得溶液的密度为1.01g/cm3,则该溶液的体积为_________ L。溶液的物质的量浓度为_________mol/L,质量分数为__________。
(2)在下列物质:① 烧碱②SO3 ③ 铁片④ 石墨⑤ 甲烷 ⑥醋酸 ⑦盐酸 ⑧硫酸钡,属于电解质的是__________(请填序号,下同),其中属于强电解质的是____________,属于非电解质的是__________,既不属于电解质又不属于非电解质的是____________。
(3)标准状况下,1 体积水能溶解448 体积HCl,所得溶液的密度为1.2g/mL,该溶液的质量分数和物质的量的浓度分别是____________、_____________。(保留1位小数)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高一上期中化学卷(解析版) 题型:选择题
下列各组中的两物质作用时,反应条件或反应物用量的改变,对生成物没有影响的是( )
A.Na2O2和CO2 B.Na和O2 C.NaOH 和CO2 D.C和O2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省赣州市十四校高二上学期期中化学试卷(解析版) 题型:填空题
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g)+2H2(g) CH3OH(g)ΔH
CH3OH(g)ΔH
(1)能判断反应达到平衡状态的依据是 (填字母序号)。
A.2V 逆(H 2) = V正(CO)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H 2的浓度都不再发生变化
E.容器内CO、H 2、CH3OH的浓度之比为1:2:1
F、CO、H2 、CH3OH的速率之比为1:2:1
(2)CO在不同温度下的平衡转化率与压强的关系如图1,该反应△H 0(填“>”或“<”)
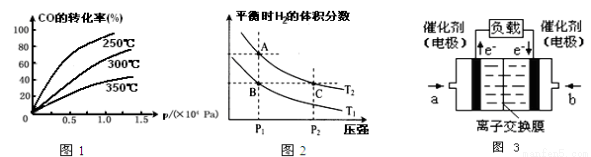
(3)一定温度下,将4a mol H 2和2amol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则:
①该反应的平衡常数为 。
②若此时再向该容器中投入a mol CO、2amol H 2 和amol CH3OH,判断平衡移动的方向是 (“正向移动”“逆向移动”或“不移动”);
③在其他条件不变的情况下,将容器体积压缩到原来的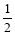 ,与原平衡相比
,与原平衡相比 ,下列有关说法正确的是 (填字母).
,下列有关说法正确的是 (填字母).
A.H2的浓 度减小;
度减小;
B.正反应速率加快,逆反应速率也加快;
C.甲醇的物质的量增加;
D.重新平衡时,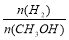 增大;
增大;
(4)上图2表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A C,由状态B到状态A,可采用 的方法(填“升温”或“降温”).
(5)甲醇燃料电池(电解质溶液为KOH溶液)结构示意图3,写出 a处电极上发生的电极反应式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com