
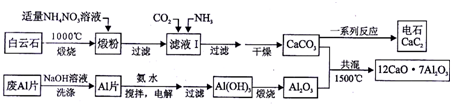
分析 白云石煅烧发生反应:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,MgCO3$\frac{\underline{\;高温\;}}{\;}$MgO+CO2↑,在锻粉中加入适量的NH4NO3溶液后,镁化合物几乎不溶,由于NH4NO3溶液水解显酸性,与CaO反应生成Ca(NO3)2和NH3•H2O,故过滤后溶液中含Ca(NO3)2和NH3•H2O,将CO2和NH3通入滤液I中后发生反应:Ca(NO3)2+2NH3+CO2+H2O=CaCO3↓+2NH4NO3,据此分析滤液中的阴离子;若滤液Ⅰ中仅通入CO2,会造成CO2过量,废铝片加入氢氧化钠溶液反应生成偏铝酸钠溶液,用NaOH溶液可除去废Al片表面的氧化膜,电解制备Al(OH)3时,电极分别为Al片和石墨,在碳酸钠溶液中搅拌电解,得到氢氧化铝,过滤加热灼烧得到氧化铝,碳酸钙和氧化铝共混加热1500°C得到七铝十二钙,据此分析产物,
(1)锻粉是由白云石高温煅烧而来;用适量NH4NO3溶液浸取煅粉后,镁化合物几乎不溶,即得Mg(OH)2的饱和溶液,根据Mg(OH)2的Ksp来计算;CaSO4微溶于水;
(2)在锻粉中加入适量的NH4NO3溶液后,镁化合物几乎不溶,由于NH4NO3溶液水解显酸性,与CaO反应生成Ca(NO3)2和NH3•H2O,故过滤后溶液中含Ca(NO3)2和NH3•H2O,将CO2和NH3通入滤液I中后发生反应:Ca(NO3)2+2NH3+CO2+H2O=CaCO3↓+2NH4NO3,据此分析滤液中的阴离子;若滤液Ⅰ中仅通入CO2,会造成CO2过量,据此分析产物;
(3)制乙炔的杂质气体之一PH3,经分离后与甲醛及盐酸在70℃、Al(OH)3催化的条件下,可合成THPC阻燃剂{[P(CH2OH)4]Cl },该反应的化学方程式为PH3+4 HCHO+HCl $\frac{\underline{\;氢氧化铝\;}}{70℃}$[P(CH2OH)4]Cl;
(4)电解制备Al(OH)3时,电极分别是Al片和石墨,阳极是铝失电子在氨水中生成氢氧化铝沉淀;
(5)若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO.则为了维持热平衡,所以每生产1molCaC2,则投料的量为:1molCaO、而投入碳的量为:3mol+$\frac{a}{\frac{b}{2}}$=7.2mol.
解答 解:(1)锻粉是由白云石高温煅烧而来,在煅烧白云石时,发生反应:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,MgCO3$\frac{\underline{\;高温\;}}{\;}$MgO+CO2↑,故所得锻粉主要含MgO和CaO,CaSO4微溶于水,如果用(NH4)2SO4代替NH4NO3,会生成CaSO4沉淀引起Ca2+的损失,
故答案为:CaO;CaSO4微溶于水,用(NH4)2SO4代替NH4NO3,会生成CaSO4沉淀引起Ca2+的损失;
(2)在锻粉中加入适量的NH4NO3溶液后,镁化合物几乎不溶,由于NH4NO3溶液水解显酸性,与CaO反应生成Ca(NO3)2和NH3•H2O,故过滤后溶液中含Ca(NO3)2和NH3•H2O,将CO2和NH3通入滤液I中后发生反应:Ca(NO3)2+2NH3+CO2+H2O=CaCO3↓+2NH4NO3,故滤液中的阴离子主要为NO3-,还含有OH-;若滤液Ⅰ中仅通入CO2,会造成CO2过量,则会生成Ca(HCO3)2,从而导致CaCO3产率降低,
故答案为:Ca(HCO3)2;
(3)制乙炔的杂质气体之一PH3,经分离后与甲醛及盐酸在70℃、Al(OH)3催化的条件下,可合成THPC阻燃剂{[P(CH2OH)4]Cl },该反应的化学方程式为PH3+4 HCHO+HCl $\frac{\underline{\;氢氧化铝\;}}{70℃}$[P(CH2OH)4]Cl,
故答案为:PH3+4 HCHO+HCl $\frac{\underline{\;氢氧化铝\;}}{70℃}$[P(CH2OH)4]Cl;
(4)电解制备Al(OH)3时,电极分别是Al片和石墨,铝做阳极,铝是失电子在氨水中生成氢氧化铝沉淀,则电解池的阳极电极反应式是:Al-3e-+3NH3?H2O=Al(OH)3↓+3NH4+,
故答案为:Al-3e-+3NH3?H2O=Al(OH)3↓+3NH4+;
(5)CaO(s)+3C(s)═CaC2(s)+CO(g)△H=+a KJ/mol
2C(s)+O2(g)═2CO(g)△H=-b KJ/mol
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO.则为了维持热平衡,每生产64Kg CaC2,物质的量=$\frac{64000g}{64g/mol}$=1000mol,所以每生产1000molCaC2,则投料的量为:1000molCaO、而投入碳的量为:(3mol+$\frac{a}{\frac{b}{2}}$mol)×1000,则为了维持热平衡,每生产64Kg CaC2,物质的量=$\frac{64000g}{64g/mol}$=1000mol,则投料的量:n(CaO)+n(C)═1000mol+(3mol+$\frac{a}{\frac{b}{2}}$mol)×1000=$\frac{1000(2a+4b)}{b}$mol,
故答案为;$\frac{1000(2a+4b)}{b}$.
点评 本题是一道非常典型的工艺流程图题,综合性较强,综合了元素化合物、电解池和原电池的知识考查,题目难度中等.


 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:选择题
| A. | 23 g Na变为Na+时得到的电子数为NA | |
| B. | 18 g水所含的电子数为NA | |
| C. | 16 g O2与16 g O3所含的原子数均是NA | |
| D. | 常温常压下,46 g的NO2和N2O4混合气体含有的分子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com