
| A. | 1:1 | B. | 5:3 | C. | 33:11 | D. | 11:4 |
分析 CO2、CH4组成的混合气在同温同压下与氮气的密度相同,可知混合气体的平均相对分子质量等于氮气的相对分子质量,即为28,则二氧化碳与甲烷的平均相对分子质量为28,即满足二氧化碳与甲烷的平均相对分子质量为28即可,根据十字交叉法计算CO2、CH4的物质的量之比.以此解答判断.
解答 解:CO2、CH4组成的混合气在同温同压下与氮气的密度相同,可知混合气体的平均相对分子质量等于氮气的相对分子质量,即为28,则二氧化碳与甲烷的平均相对分子质量为28,即满足二氧化碳与甲烷的平均相对分子质量为28即可,
利用十字相乘法得二氧化碳和氢气的物质的量之比: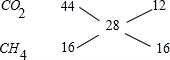
二氧化碳和甲烷的物质的量之比为12:16=3:4,质量之比为3×44:4×16=33:11,
故选:C.
点评 本题考查混合物的计算,题目难度不大,注意有关计算公式的运用,可以利用十字交叉法计算二者物质的量之比.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
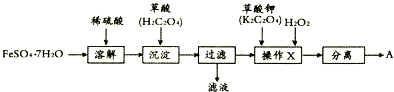
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为△H=-890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 已知H2O(l)=H2O(g)△H=+44 kJ/mol,则2gH2(g)完全燃烧生成液态水比生成气态水多释放22kJ的热量 | |
| C. | 硝酸铵溶于水温度降低,这个过程发生的是吸热反应 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下△H的相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
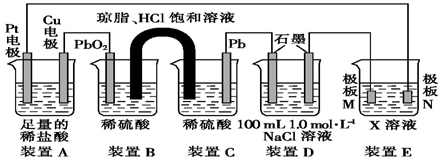
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
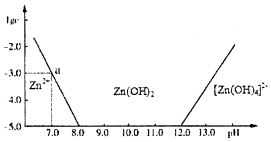 锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.
锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.| C(HCl)/(mol•L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| C(PbCl2)/(mol•L-1)×10-3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.6 | B. | 0.9 | C. | 1.6 | D. | 1.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
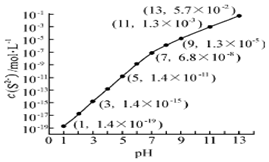 自然界中存在着S元素,它对生物具有重要的作用.
自然界中存在着S元素,它对生物具有重要的作用.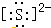 .
.| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
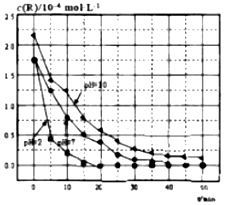
| A. | 对比pH=7和pH=10的曲线,在同一时刻,能说明R的起始浓度越大,降解速率越大 | |
| B. | 对比pH=2和pH=7的曲线,说明溶液酸性越强,R的降解速率越大 | |
| C. | 在0~20min之间,pH=2时R的平均降解速率为0.0875×10-4mol•L-1•min-1 | |
| D. | 50min时,pH=2和pH=7时R的降解百分率相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com