
【题目】在Cl2 + SO2 + 2H2O = 2HCl + H2SO4的反应中:
(1)氧化剂是______________,还原剂是__________________,
(2)若反应消耗7.1g Cl2,同时消耗标准状况下SO2的体积约为____________L,反应生成H2SO4物质的量是___________mol。
【答案】Cl2SO22.24L0.1mol
【解析】
在氧化还原反应中得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,氧化剂发生还原反应而被还原,还原剂发生氧化反应而被氧化,根据氯气和二氧化硫、硫酸之间的关系式进行计算。
(1)该反应SO2+Cl2+2H2O=2HCl+H2SO4中,Cl元素的化合价由0价变为-1价,S元素的化合价由+4价变为+6价,所以氯气是氧化剂,二氧化硫是还原剂,故答案为:Cl2;SO2;
(2)反应消耗7.1g Cl2,即n(Cl2)=![]() =0.1mol,则耗标准状况下SO2的体积约0.1mol×22.4L/mol=2.24L,反应生成H2SO4物质的量是n(H2SO4)=n(Cl2)=0.1mol。
=0.1mol,则耗标准状况下SO2的体积约0.1mol×22.4L/mol=2.24L,反应生成H2SO4物质的量是n(H2SO4)=n(Cl2)=0.1mol。


科目:高中化学 来源: 题型:
【题目】化学与生活息息相关。下列说法错误的是
A.铝合金大量用于高铁建设B.活性炭具有除异味和杀菌作用
C.生石灰可用作袋装食品干燥剂D.光束通过云、雾会产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请完成下列化学实验安全的有关问题:
(1)在盛放浓硫酸的试剂瓶的标签上应印有下列警示标志中的______。
A.  B.
B. C.
C. D.
D.
(2)下列做法正确的是__________(填序号)。
①蒸发时,用手直接拿蒸发皿
②实验室中用![]() 制备并用排水法收集
制备并用排水法收集![]() ,实验结束时,先撤酒精灯,再撤导气管
,实验结束时,先撤酒精灯,再撤导气管
③给试管中的液体加热时,试管口不要朝着任何人
④向燃着的酒精灯中添加酒精
⑤熄灭酒精灯时应用灯帽盖灭
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某气态烃X在标准状态下的密度为1.16 g/L,A能发生银镜反应,E具有特殊香味,有关物质的转化关系如下:

请回答:
(1)B中含有的官能团名称是_____________,反应④的反应类型为_____________。
(2)写出反应①的化学方程式_____________。
(3)下列说法正确的是_____________。
A.有机物D在加热条件下可以使黑色的氧化铜变红
B.有机物A分子中的所有原子在同一平面上
C.有机物B与C在一定条件下可以反应生成有机物E
D.有机物E中混有B和D,可用NaOH溶液将E分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。

(1)步骤1的主要操作是__________,需用到的玻璃仪器除烧杯、玻璃棒外有________。
(2)步骤2中发生反应的化学方程式为___________________________
(3)步骤3中发生反应的化学方程式为___________________________
(4)步骤4中涉及的操作是:蒸发浓缩、_________、过滤、洗涤、烘干。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下焦炭、石英砂的混合物与氯气反应可生成SiCl4。以下是实验室制备SiCl4的装置示意图(注:S1Cl4遇水易水解)。
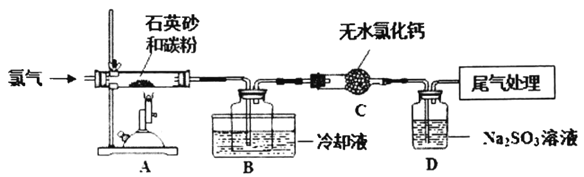
请回答:
(1)用MnO2和浓盐酸制取氯气,为了得到纯净干燥的氯气,可将制得的氯气依次通过盛有____、浓硫酸的洗气瓶。
(2)装置C的作用是______。
(3)设计一个实验方案,用化学方法检验装置D中生成的SO42-_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组向一定量的NaHSO3溶液(加入少量淀粉)中加入稍过量的KIO3 溶液,一段时![]() 间后,溶液突然变蓝色。为进一步研究有关因素对反应速率的影响,探究如下。
间后,溶液突然变蓝色。为进一步研究有关因素对反应速率的影响,探究如下。
(1)查阅资料 知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由第一步反应决定。已知第一步反应的离子方程式为IO3—+3HSO3—===3SO42—+I—+3H+,则第二步反应的离子方程式为________________。
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下。
编号 | 0.01mol/LNaHSO3溶液/mL | 0.01mol/L KIO3 溶液/mL | H2O/mL | 反应温度 /℃ | 溶液变蓝所用时间t/s |
① | 6.0 | 10.0 | 4.0 | 15 | t1 |
② | 6.0 | 14.0 | 0 | 15 | t2 |
③ | 6.0 | a | b | 25 | t3 |
实验①②是探究_______________对反应速率的影响,表中t1___________t2(填“>”、“=”或“<”);
实验①③是探究温度对反应速率的影响,表中a=_____________,b=_____________。、
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率 逐渐增大。该小组对其原因提出如下假设,请你完成假设二。
假设一:生成的SO42—对反应起催化作用;
假设二:___________________________;……
(4)请你设计实验验证上述假设一,完成下表中内容。
实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲) 在烧杯乙中先加入少量①_____,其他条件与甲完全相同,用速率检测仪测定起始时的反应速率v(乙) | ②若v(甲)___v(乙),则假设一不成立 ③若v(甲)___v(乙),则假设一成立 (填“>”、“=”或“<”) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,SO2与NaOH反应后的溶液中存在含硫微粒H2SO3、HSO3-和SO32-,三者中各自所占的物质的量分数随溶液pH变化的关系如图所示。下列说法正确的是

A. a表示SO32-物质的量分数随溶液pH变化的曲线
B. pH=8昀溶液中:c(HSO3-)>c(SO32-)
C. pH=7的溶液中:c(Na+)= c(HSO3-)+2c(SO32-)
D. 1mol/L的NaHSO3溶液中存在: c(H2SO3)=c(H+)+c(OH-)+c(SO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na2SO4 和K2SO4 的混合溶液中,如果c(Na+)=0.2mol/L,c(SO42﹣)=x mol/L,c(K+)=y mol/L,则x和y的关系是( )
A.x=0.5y
B.x=0.1+0.5y
C.y=2(x﹣0.1)
D.y=2x﹣0.1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com