
用NA表示阿伏伽德罗常数。下列说法正确的是( )
A.标准状况下,11.2L乙烯含有的极性共价键数为NA
B.常温下,5.6LNO和5.6LO2的混合气体中含有的分子数为0.5NA
C.16.9gBaO2固体中阴、阳离子总数为0.2NA
D.含有1molFe(OH)3的氢氧化铁胶体中含有胶粒数为NA
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,不能说明反应
A(s)+2B(g)  C(g)+D(g)已达平衡状态的是 ( )
C(g)+D(g)已达平衡状态的是 ( )
A.混合气体的压强
B.混合气体的密度
C. B的物质的量浓度
B的物质的量浓度
D.气体的平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生。
Ⅰ.摩 擦剂中氢氧化铝的定性检验。
擦剂中氢氧化铝的定性检验。
取适量牙膏样品,加水充分搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是
___________________________________________________________________________。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是_________
___________________________________________________________________________。
Ⅱ.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3
沉淀质量,以确定碳酸钙的质量分数。

依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:
___________________________________________________________________________。
(4)C中反应生成BaCO3的化学方程式是__________________________________________
___________________________________________________________________________。
(5)下列各项措施中,不能提高测定准确度的是________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A~B之间增添盛有浓硫酸的洗气装置
d.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.00 g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g。则样品中碳酸钙的质量分数为________。
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表格中的各种情况,可以用下面的图象曲线表示的是( )
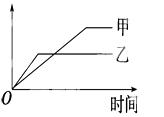
| 反应 | 纵坐标 | 甲 | 乙 | |
| A | 等质量的钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
| B | 相同质量氨,在同一容器中2NH3 | 氨气的转化率 | 500℃ | 400℃ |
| C | 在体积可变的恒压容器中,体积比1:3的N2、H2,2NH3 | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
| D | 2molSO2与1molO2,在相同温度下2SO2+O2 | SO3物质的量 | 10个大气压 | 2个大气压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
NA为阿伏伽德罗常数,下列叙述错误的是
A.常温常压下,42g乙烯和丁烯混合气体中,极性键数为 6 NA
B.1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2 NA个电子
C.由CO2和O2组成的混合气体中共有NA个分子,其中的氧原子数为2NA
D.6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温下,4 gCH4含有NA个C-H共价键
B. 1 mol Fe与足量稀HNO3反应,转移2NA个电子
C.1 L 0. 1 mol/L NaHCO3溶液中含有0. 1NA个HCO3-
D.常温常压下,22.4 LNO2和CO2的混合气体中含有2NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
烧碱、纯碱等都是重要的化工原料。
(1)利用如图装置可以证明二氧化碳与烧碱溶液发生了反应。
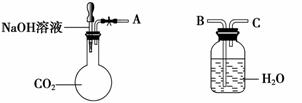
①若将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是______
_____________________________________________________________。
②若其他操作不变,将A与C连接,可观察到的现象是_____________________。
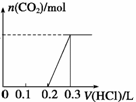
(2)向100 mL 1 mol·L-1烧碱溶液中通入一定量CO2充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,按出现的先后顺序分别是Ⅰ.NaOH、Na2CO3,Ⅱ.__________________,Ⅲ.Na2CO3、NaHCO3,Ⅳ.__________________。
①常温下,将得到的固体X重新溶于水,在所得溶液中逐滴加入盐酸,得到下面的变化图,则X的成份为 (填Ⅰ、Ⅱ、Ⅲ或Ⅳ),盐酸的浓度为 。
②若要验证白色固体X是第Ⅰ种组成,依次加入的试剂为________(填字母序号)。
a.盐酸 b.MgCl2溶液 c.BaCl2溶液 d.Ba(OH)2溶液
在验证的过程中,一定需要进行的操作是________(填字母序号)。
a.萃取 b.洗涤 c.过滤 d.分馏
③若白色固体X为第Ⅲ种组成,下列实验方案中不能测定其中NaHCO3质量分数的是________(填字母序号)。
a.取m g X与足量Ba(OH)2溶液充分反应,过滤,洗涤,烘干得n g固体
b.取m g X与足量盐酸充分反应,加热,蒸干,灼烧得n g固体
c.取m g X充分加热,减重n g
d.取m g X与足量稀硫酸充分反应,逸出的气体被足量碱石灰吸收,增重n g
④若白色固体X的质量为5.0 g,则X的组成为________(填Ⅰ、Ⅱ、Ⅲ或Ⅳ)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(I)在一定条件下,发生反应:
 aA(g) +bB(g) cC(g) △H=Q kJ/mol,其化学平衡常数K和温度的关系如下表所示:
aA(g) +bB(g) cC(g) △H=Q kJ/mol,其化学平衡常数K和温度的关系如下表所示:

依据图表判断该反应△H 0(填“>”或“<”):若其它条件保持一定,降低温度,该反应物A的转
化率 (填“增大”、“减小”或“不变”下同),化学反应速率将 。
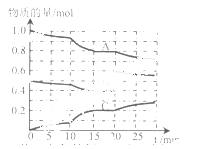
 (II)在恒定温度t℃,2L恒容密闭容器中发生反应aA(g) +bB(g) cC(g),容器中A、B、C物质的量
(II)在恒定温度t℃,2L恒容密闭容器中发生反应aA(g) +bB(g) cC(g),容器中A、B、C物质的量
变化如图所示,回答下列问题:
该化学方程式中a:b:c为 ,t℃时该反应的化学平衡常数K的值为____ 。(保留2位小数)
(2) 0~15 min内,B的平均反应速率为 ,反应达平衡时,A的转化率为 。
(3)据图判断,反应进行至20 min时,曲线发生变化的原因是 (用文字表达),反应重新达平衡时,A的体积分数将 (填“增大”、“减小”或“不变”)。
(4) 10 min到15 min的曲线变化的原因可能是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com