
| A. | 离子化合物中,一个阴离子可同时与多个阳离子之间有静电作用 | |
| B. | 离子化合物中的阳离子都是金属离子 | |
| C. | 溶于水可以导电的化合物一定是离子化合物 | |
| D. | 凡是金属元素跟非金属元素化合都形成离子化合物 |
分析 A.离子化合物中阴离子与阳离子个数可能不同;
B.铵盐为离子化合物;
C.溶于水可以导电的化合物,可能为共价化合物;
D.氯化铝为共价化合物.
解答 解:A.离子化合物中阴离子与阳离子个数可能不同,如过氧化钠,即一个阴离子可同时与多个阳离子之间有静电作用,故A正确;
B.铵盐为离子化合物,不含金属元素,故B错误;
C.溶于水可以导电的化合物,可能为共价化合物,如HCl,故C错误;
D.氯化铝为共价化合物,含金属元素与非金属元素,故D错误;
故选A.
点评 本题考查离子化合物的结构特征,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意化合物中的化学键,题目难度较大.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
| A. | 原电池放电时正极反应为VO2++2H++e-═VO2++H2O | |
| B. | 充电时阴极反应为V2+-e-═V3+ | |
| C. | 电解池的阴极反应式为3O2+6H2O+6e-═3H2O2+6OH- | |
| D. | 电解池中生成22.4 L O3(标准状况)时,转移3 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
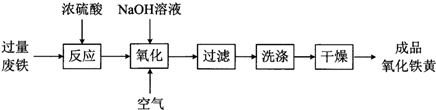
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
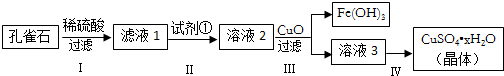
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
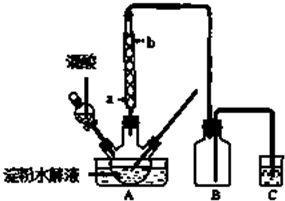
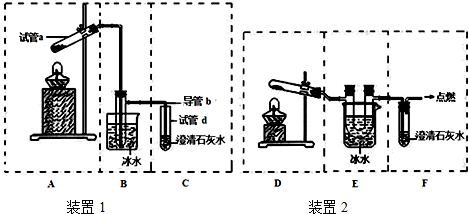
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离、提纯→确定化学式→确定实验式→确定结构式 | |
| B. | 分离、提纯→确定结构式→确定实验式→确定化学式 | |
| C. | 分离、提纯→确定实验式→确定化学式→确定结构式 | |
| D. | 确定化学式→确定实验式→确定结构式→分离、提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2CO3溶液中,$\frac{1}{2}$c(K+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 某浓度的NaAc溶液的pH=8,则该溶液中的c(Na+)-c(Ac-)=9.9×10-7mol/L | |
| C. | 物质的量浓度相等的①NH4Cl、②(NH4)2SO4两种溶液,c(NH4+)大小顺序为:①>② | |
| D. | 10mLpH=12的烧碱溶液中加入pH=2的酸HA至中性,所需酸溶液的体积V≥10mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 | |
| B. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | Zn 具有还原性和导电性,可用作锌锰干电池的负极材料 | |
| D. | 由2 mol H原子形成1 mol H-H键要吸收热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
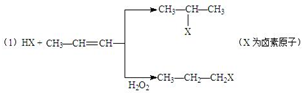
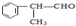 的物质,该物质是一种香料.
的物质,该物质是一种香料.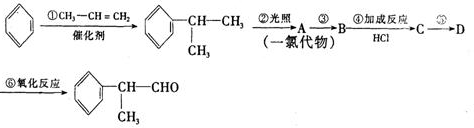
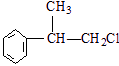 、
、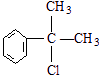 .
.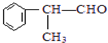 的官能团的名称醛基.
的官能团的名称醛基.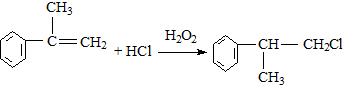 .
.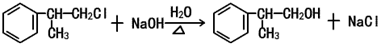 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com