
| A. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.25 NA | |
| B. | 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成56g N2时,转移的电子数目为3.75NA |
分析 A、标况下,5.6L二氧化碳的物质的量为0.25mol,而过氧化钠与二氧化碳的反应中,当有1mol二氧化碳参与反应时,反应转移1mol电子;
B、氢氧化钠溶液中,氢氧根离子抑制了水的电离,水中氢离子是水电离的;
C、燃料电池中正极发生还原反应,氢氧燃料电池中正极氧气得到电子,1mol氧气完全反应得到4mol电子;
D、此反应中,当生成4mol氮气时,转移15mol电子.
解答 解:A、标况下,5.6L二氧化碳的物质的量为0.25mol,而过氧化钠与二氧化碳的反应中,当有1mol二氧化碳参与反应时,反应转移1mol电子,则0.25mol二氧化碳转移0.25mol电子即0.25NA个,故A正确;
B、pH=13的氢氧化钠溶液中氢氧根离子浓度为0.1mol/L,该溶液中氢离子浓度为:1×10-13mol/L,氢氧化钠溶液中的氢离子是水电离的,则水电离的氢氧根离子的物质的量为1×10-13mol,水电离的OH-离子数目为1×10-13NA,故B错误;
C、标况下22.4L气体的物质的量为1mol,氢氧燃料电池中正极氧气得到电子,1mol氧气完全反应转移了4mol电子,则电路中通过的电子数目为4NA,故C错误;
D、此反应中,当生成4mol氮气时,转移15mol电子,故当生成56g氮气即2mol氮气时,转移7.5mol电子即7.5NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题

 .则:
.则: .
.| A→H | A→B | B→C | F→G | |
| 反应类型 |

 +H2$\stackrel{催化剂}{→}$
+H2$\stackrel{催化剂}{→}$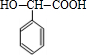 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cu2++2OH-═Cu(OH)2↓ CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | CO32-+2H+═CO2↑+H2O BaCO3+2HCl═BaCl2+CO2↑+H2O | |
| C. | Ca2++CO32-═CaCO3↓ Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3 | |
| D. | H++OH-═H2O 2KOH+H2SO4═K2SO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要的用途,同时也是一种重要的化工原料.
CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要的用途,同时也是一种重要的化工原料.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com