
【题目】实验室用浓盐酸与二氧化锰固体加热反应来制备氯气(MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O),某兴趣小组制取氯气并进行氯气的性质实验装置如图,请回答下列问题:
MnCl2+Cl2↑+2H2O),某兴趣小组制取氯气并进行氯气的性质实验装置如图,请回答下列问题: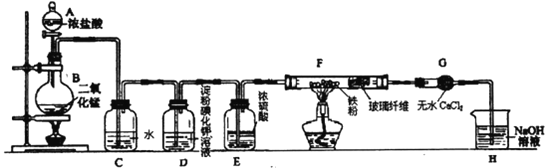
(1)仪器A的名称是________。
(2) C中反应的化学方程式为____,所得溶液除水分子外,还含有的分子和离子中正确的是____。
A.Cl2、HCl、HClO、H+、Cl﹣ B.Cl2、Mn2+、HClO、H+、Cl﹣
C.Cl2、HClO、H+、Cl﹣、ClO﹣ D.Cl2、HCl、HClO、H+、Mn2+
(3)实验中观察到D溶液变蓝色,查资料得知淀粉碘化钾溶液是淀粉和碘化钾(KI)的混合溶液,碘单质(I2)遇淀粉显蓝色,且氯气可以从KI中置换出碘单质,写出该反应的化学方程式为_________。
(4)F中氯气与铁粉反应制备无水三氯化铁,查资料知该化合物呈棕红色、易吸水潮解,100℃左右时升华。E中浓硫酸的作用是___,双通管F中玻璃纤维(不参与反应)的作用是________。
(5)H中盛有NaOH溶液,其作用是_____, 发生反应的离子方程式为_____。
【答案】分液漏斗 Cl2+H2O=HCl+HClO C Cl2+2KI=I2+2KCl 干燥氯气 防止氯化铁堵塞后面的导管 吸收尾气中的氯气 Cl2+2NaOH=NaCl+NaClO+H2O
【解析】
(1)依据仪器形状可知:装置A盛放浓盐酸的为分液漏斗;
(2)氯气通入C水中生成HCl和HClO,其反应的方程式为:Cl2+H2O=HCl+HClO;HCl在溶液中完全电离出H+、Cl-,HClO在溶液中部分电离出H+、ClO-,所以氯水中含有的微粒为Cl2、HClO、H+、Cl-、ClO-;
(3)氯气具有强的氧化性,能够氧化碘化钾生成单质碘,反应方程式:Cl2+2KI=I2+2KCl,碘遇到淀粉变蓝;
(4)制取的氯气中含有水蒸气,Fe与干燥的氯气反应,要得到干燥氯气,应除去氯气中的水蒸气,浓硫酸具有吸水性,能够干燥氯气;生成的氯化铁易堵塞导管,双通管F中加玻璃纤维可以防止氯化铁进入后面的导管,引起导管堵塞;
(5)氯气有毒,要进行尾气处理,用氢氧化钠溶液吸收,氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O;
(1)依据仪器形状可知:装置A盛放浓盐酸的为分液漏斗;故答案为:分液漏斗;
(2)氯气通入C水中生成HCl和HClO,其反应的方程式为:Cl2+H2O=HCl+HClO;HCl在溶液中完全电离出H+、Cl-,HClO在溶液中部分电离出H+、ClO-,所以氯水中含有的微粒为Cl2、HClO、H+、Cl-、ClO-;故答案为:Cl2+H2O=HCl+HClO;C;
(3)氯气具有强的氧化性,能够氧化碘化钾生成单质碘,反应方程式:Cl2+2KI=I2+2KCl,碘遇到淀粉变蓝;故答案为:Cl2+2KI=I2+2KCl;
(4)制取的氯气中含有水蒸气,Fe与干燥的氯气反应,要得到干燥氯气,应除去氯气中的水蒸气,浓硫酸具有吸水性,能够干燥氯气;生成的氯化铁易堵塞导管,双通管F中加玻璃纤维可以防止氯化铁进入后面的导管,引起导管堵塞;故答案为:干燥氯气;防止氯化铁堵塞后面的导管;
(5)氯气有毒,要进行尾气处理,用氢氧化钠溶液吸收,氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O;故答案为:吸收尾气中的氯气;Cl2+2NaOH=NaCl+NaClO+H2O。


科目:高中化学 来源: 题型:
【题目】有600mL某种混合物溶液,只可能含有以下离子中的若干种![]()
![]() 、
、![]() 、
、![]() ,现将此溶液分成三等份,进行如下实验
,现将此溶液分成三等份,进行如下实验
①向第一份中加入AgNO3溶液,有沉淀产生;
②向第二份中加足量NaOH溶液并加热后,收集到气体0.04 mol;(![]() 条件为加热)
条件为加热)
③向第三份中加足量BaCl2溶液后,得干燥的沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验,以下推测错误的是( )
A.K+一定存在
B.Ba2+、Mg2+一定不存
C.Cl- 一定存在
D.混合溶液中![]() 的浓度为0.1 mol/L
的浓度为0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )。
A. 根据反应Cu+H2SO4![]() CuSO4+H2↑可推知Cu的还原性比H2的强
CuSO4+H2↑可推知Cu的还原性比H2的强
B. 在反应CaH2+2H2O===Ca(OH)2+2H2↑中,水作氧化剂
C. 反应3NO2+H2O===2HNO3+NO中氧化剂和还原剂的物质的量之比是3∶1
D. Cl2的氧化性强于I2的氧化性,故置换反应I2+2NaClO3===2NaIO3+Cl2不能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于区域3的是( )
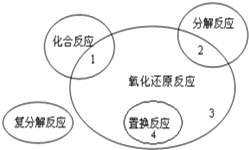
A.2F2+2H2O═4HF+O2
B.AgNO3+NaCl═AgCl↓+NaNO3
C.3CO+Fe2O3 ![]() 2Fe+3CO2
2Fe+3CO2
D.MgCl2(熔融)![]() Mg+Cl2↑
Mg+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三位分别来自法国、美国、荷兰的科学家因研究“分子机器的设计与合成”而获得2016年诺贝尔化学奖。纳米分子机器日益受到关注,机器的“车轮”常用组件如下,下列说法正确的是( )
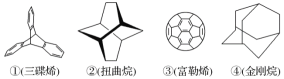
A. ①④互为同分异构体
B. ①③均能发生加成反应
C. ①②③④均属于不饱和烃
D. ①②③④的一氯代物均只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性ZnO在橡胶、塑料等工业中有重要应用,某工厂以含铅锌烟气(主要成分是ZnO、PbO,还有少量FeO、CuO)制备活性ZnO的工艺流程如下:

(1)下图为温度与Zn、Pb元素浸出率的关系图,“酸浸”时采用30℃而不是更高的温度的原因是:①减少盐酸挥发;②____。

(2)“氧化”的目的是除去酸浸液中的Fe2+,在pH约为5.1的溶液中,加入高锰酸钾溶液,生成MnO2和Fe(OH)3沉淀,该反应的离子方程式为____。
(3)①若“过滤I”所得的滤液浑浊,则处理的方法为____。
②“除杂”时,滤渣Ⅱ的主要成分是Cu、Pb,试剂X应为____。
(4)在“过滤Ⅱ”后的溶液中加入Na2CO3溶液,生成碱式碳酸锌[Zn2(OH)2CO3]等物质。
①该反应的化学方程式为____。
②检验碱式碳酸锌洗涤干净的操作为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置或操作设计正确、且能达到目的的是( )
A. 实验①,设计铜银双液原电池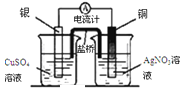
B. 实验②,将钢闸门与外接电源的负极相连,可防止钢闸门腐蚀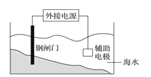
C. 实验③,准确量取一定体积K2Cr2O7标准溶液![]()
D. 实验④,蒸干氯化镁溶液制MgCl2·6H2O 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴元素由于其良好的物理化学性质,被广泛应用于生产生活中。从含钴废料(含CoO、Co2O3、单质Al、Li等)中制取粗CoCl2·6H2O的流程如下所示。
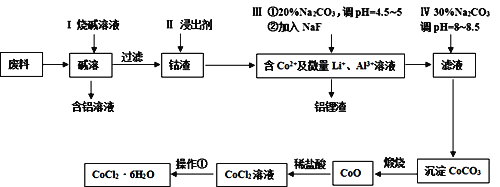
请回答下列问题:
(1)步骤I中主要发生的化学反应方程式为______。
(2)已知Co2O3具有强氧化性,若步骤II中浸出剂为盐酸,造成的后果是_______。
(3)步骤Ⅲ中①的目的是除去Al3+,写出该步反应的离子方程式______。
(4)若在实验室煅烧CoCO3,所需的硅酸盐质仪器除酒精灯和玻璃棒外,还有______、______(填仪器名称)。
(5)操作①是在HCl氛围中进行的,其步骤是______、_____、过滤、洗涤、干燥。洗涤过程中可以用工业酒精代替水,其优点是_____。
(6)某同学用标准硝酸银溶液滴定未知浓度的CoCl2溶液,下列可作为指示剂的是____(填选项,忽略亚钴离子的颜色干扰)
A.KCl B.KSCN C.K2CrO4 D.K2S
已知几种物质在20℃时的颜色及Ksp值如下表
化学式 | AgCl | AgSCN | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黑色 | 红色 |
Ksp | 2.0×10-10 | 1.0×10-12 | 2.0×10-48 | 2.0×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合图回答问题:如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
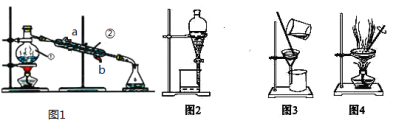
(1)写出上述装置中仪器的名称:①________。
(2)若利用上述装置分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物,还缺少的仪器有________,图1中仪器 ②是从______口进水(填a或b)。
(3)图2在分液时为使液体顺利滴下,除打开活塞外,还应进行的具体操作是______
(4)从氯化钾溶液中得到氯化钾固体,选择装置______(填代表装置图的序号,下同);除去自来水中的Cl等杂质,选择装置______。
(5)实验室常用上述装置分离碘水中的碘,进行该操作时,需在碘水中加一试剂,在选择试剂时,下列性质你认为哪些性质是必需的:________(填序号)。
①常温下为液态 ②I2在其中溶解程度大 ③与水互不相容 ④密度要比水大。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com