
科目:高中化学 来源:2015-2016学年陕西西安第一中学高一上期中考试化学试卷(解析版) 题型:选择题
下列溶液中NO3-的物质的量浓度最大的是( )
A.500 mL 1 mol·L-1的KNO3溶液
B.500 mL 1 mol·L-1的Ba(N O3)2溶液
O3)2溶液
C.1000 mL 0.5 mol·L-1的Mg(NO3)2溶液
D.1000 mL 0.5 mol·L-1的Fe(NO3)3溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北衡水冀州中学高一上月考三理化学卷(解析版) 题型:选择题
现有24mL浓度为0.05mol/L的Na2SO3溶液恰好与20mL浓度0.02mol/L的K2Cr2O7溶液完全反应。已知Na2SO3被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中化合价为( )
A. +2 B. +3 C. +4 D. +5
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建厦门一中高一上期中考试化学试卷(解析版) 题型:选择题
某实验室合成了一种可溶的金属氯化物(RClx),为了测定该金属氯化物的成分,研究人员做了以下实验:取物质的量浓度为0.05 mol·L-1的金属氯化物(RClx) 溶液20 mL,使之恰好与20 mL 0.15 mol·L-1的AgNO3溶液完全反应。则该氯化物的化学式为
A.RCl B.RCl2 C.RCl3 D.RCl4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建厦门一中高二上期中考试化学试卷(解析版) 题型:选择题
北京残奥会吉祥物是以牛为形象设计的“福牛乐乐”。有一种有机物的键线式也酷似牛,如下图所示,故称为牛式二烯炔醇。下列有关说法不正确的是

A.牛式二烯炔醇含有3种官能团
B.牛式二烯炔醇分子内能发生消去反应
C.1 mol牛式二烯炔醇最多可与6 molBr2发生加成反应
D.牛式二烯炔醇可发生取代反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年北京顺义牛栏山一中高一上期中化学试卷(解析版) 题型:选择题
下图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是
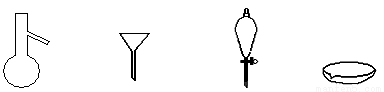
A. 蒸馏、蒸发、萃取、过滤 B. 蒸馏、过滤、萃取、蒸发
C. 萃取、过滤、蒸馏、蒸发 D. 过滤、蒸发、萃取、蒸馏
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高二上期中测试化学试卷(解析版) 题型:实验题
某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入高锰酸钾溶液时,溶液褪色总是先慢后快.即反应速率由小变大.为此,甲同学做了如下实验进行探究:
(已知:MnO4-在酸性环境下的还原产物是Mn2+ )
【实验用品】仪器:试管(若干个)、胶头滴管、100mL容量瓶、250mL容量瓶、10mL量筒、托盘天平、玻璃棒、烧杯、药匙
(1)0.10mol/L H2C2O4溶液的配制:
实验室欲配制100mL 0.10mol/L H2C2O4溶液,需要称取草酸晶体(H2C2O4·2H2O) g(精确到0.1g);实验中需要用到的玻璃仪器有:玻璃棒、烧杯、胶头滴管和 .
(2)反应的速率变化的探究:
在1号和2号试管中分别加入2mL0.10mol/L H2C2O4溶液,在1号试管中加入硫酸锰固体.然后在两支试管中加入4mL 0.010mol/L KMnO4溶液和几滴稀硫酸.现象如下表所示:
试管1 | 试管2 | |
实验现象 | 褪色很快 | 褪色很慢 |
褪色时间/s | 4秒 | 31秒 |
请回答下列问题:
①甲同学进行该实验还缺少的实验仪器是: .
②H2C2O4溶液与酸性的KMnO4溶液反应的离子方程式为: .
③同学测出的颜色变化的时间是以下列哪个选项为依据的 .
A、从KMnO4溶液刚好接触H2C2O4溶液开始,溶液由紫红色变为近乎无色,半分钟之内不再出现紫 红色为止.
B、从KMnO4溶液刚好接触H2C2O4溶液开始,溶液由无色变为紫红色为止.
C、从KMnO4溶液接触H2C2O4溶液开始,溶液由紫红色变为近乎无色为止.
④甲同学认为该反应褪色由慢到快的原因是 .
于是甲同学得出结论 .
(3)乙同学和丙同学从甲同学的实验探究中得到启示,他们也分别提出了能影响该溶液化学反应速率 因素的另外两种可能原因,你认为他们提出的两种可能原因是:
I II
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省高二上10月月考化学试卷(解析版) 题型:选择题
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol·L-1的NaHSO3溶液(含少量淀粉)10.0 mL、
KIO3(过量)酸性溶液40.0 mL混合,记录10~55 ℃间溶液变蓝时间,55 ℃时未观察到溶液变蓝,实验结果如右图。据图分析,下列判断不正确的是
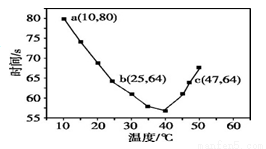
A.40 ℃之前与40 ℃之后溶液变蓝的时间随温度的变化趋势相反
B.图中a点对应的NaHSO3反应速率为5.0×10-5 mol·L-1·s-1
C.图中b、c两点对应的NaHSO3反应速率相等
D.温度高于40 ℃时,淀粉不宜用作该实验的指示剂
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上学期期中(文)化学试卷(解析版) 题型:填空题
在300 ml 2 mol·L-1 H2SO4溶液中,H+的浓度是______,H+的物质的量是______,SO42-的数目是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com