
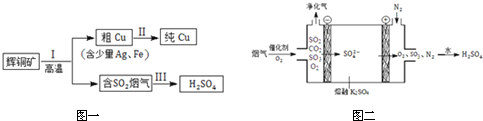
分析 (1)化合物中S元素常见负化合价为-2价;
(2)根据电解原理分析电解精炼铜的阳极材料;依据溶液中阳离子的放电顺序回答;
(3)SO2-O2-H2SO4形成燃料电池,通O2的电极为正极发生还原反应,通SO2的电极为负极发生氧化反应,转化为H2SO4,根据电解质溶液是酸性的,写出负极反应式;阳离子在电解质溶液中由负极移动到正极,据此解答即可;
(4)①溴水具有强氧化性,亚硫酸根具有还原性,据此解答即可;
②生成沉淀越多,说明烟气中二氧化硫含量越高,脱除率越低,据此解答即可.
解答 解:(1)化合物中S元素常见负化合价为-2价,故Cu的化合价为+1,故答案为:+1;
(2)①电解法炼铜时,阳极发生氧化反应、阴极发生还原反应,所以阳极为粗铜板,粗铜板中的金、银还原性比铜的弱,反应后以单质的形式在电解槽阳极的槽底,在电解槽的阴极铜离子得到电子生成金属铜,该电极反应为:Cu2++2e-═Cu,故答案为:正;
②由于Cu2+的氧化性大于Fe2+的氧化性,故溶液中的铜离子放电析出,故答案为:Cu2+的氧化性大于Fe2+的氧化性;
(3)①依据题意得出二氧化硫燃料电池中,氧气在原电池的正极得到电子,故答案为:O2;
②熔融硫酸钾中硫酸根失去电子,在原电池的负极放电,电极反应方程式为:2SO42--4e-=2SO3↑+O2↑,故答案为:2SO42--4e-=2SO3↑+O2↑;
(4)①溴水具有强氧化性,亚硫酸根具有还原性,发生反应的离子反应方程式为:SO32-+Br2+H2O=SO42-+2Br-+2H+,故答案为:SO32-+Br2+H2O=SO42-+2Br-+2H+;
②生成沉淀越多,说明烟气中二氧化硫含量越高,脱除率越低,故答案为:低.
点评 本题主要考查的是电解及流程分析、电化学原理等,综合性较强,难度较大.


科目:高中化学 来源: 题型:选择题
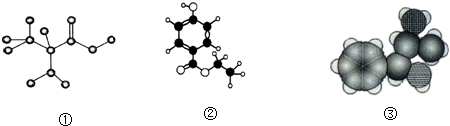
| A. | 图①是球棍模型,其化学式为:C3H7O2N,是一种蛋白质 | |
| B. | 图②是比例模型,其化学式为:C9H13NO,该物质既能与盐酸反应,又能与氢氧化钠溶液反应 | |
| C. | 图③是球棍模型,其化学式为:C9H10O3,1 mol该物质能消耗3mol氢氧化钠 | |
| D. | 图③是比例模型,其化学式为:C9H13ON,能够发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
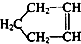 可简写为
可简写为 ,降冰片烯的分子结构可表示为:
,降冰片烯的分子结构可表示为: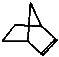
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1L 1mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| B. | 1mol羟基中电子数为10NA | |
| C. | 在反应中,每生成3mol I2转移的电子数为6NA | |
| D. | 常温常压下,22.4L乙烯中C-H键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
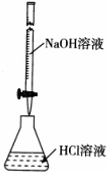
| A. | 根据图,若滴定前仰视读数,滴定终点时俯视读数,则测定的盐酸浓度偏高 | |
| B. | 250℃时,难溶物XY和AB3的KSP分别为1.0×10-10和2.7×10-15,则饱和溶液中c(X+)一定大于c(A 3+ ) | |
| C. | 每个Fe(OH)3胶体粒子含一个氢氧化铁分子 | |
| D. | 某溶液中存在K+?HCO3-?CO32-?OH-?H+,其离子浓度大小顺序可能为c(K+)>c(HCO-3)>c(H+)>c(CO2-3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸溶液中存在乙酸分子,能证明乙酸是一种弱酸 | |
| B. | 丙醛和乙醛都有醛基,都能和银氨溶液、新制氢氧化铜反应 | |
| C. | 除去工业乙醇中少量水常加入生石灰,并蒸馏 | |
| D. | 油脂、淀粉、蛋白质、纤维素属于天然高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第4周期第VA族 | B. | 第5周期第IIIA族 | C. | 第5周期第Ⅳ族 | D. | 第4周期第IIIA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 试剂、用品 | 预期现象 | |
| 甲 | 酸性高锰酸钾溶液 | 溶液紫红色褪去 |
| 乙 | 溴水 | 溴水褪色 |
| 丙 | 铜丝 酒精灯 | 铜丝由黑色变成光亮的红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com