
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
| 60×40% |
| 12 |
| 60×53.3% |
| 16 |
| 60×6.7% |
| 1 |
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
| 6g |
| 60g/mol |
| 1.12L |
| 22.4L/mol |
| 0.05mol×2 |
| 0.1mol |


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:

| 催化剂 |
| △ |
| 催化剂 |
| △ |
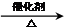 2CH3CHO+2H2O
2CH3CHO+2H2O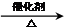 2CH3CHO+2H2O
2CH3CHO+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
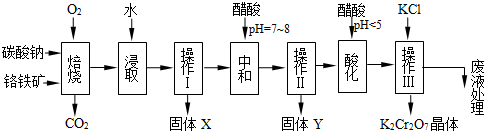
| 750℃ |
| 750℃ |
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
| 26m |
| 17n |
| 26m |
| 17n |
查看答案和解析>>
科目:高中化学 来源: 题型:
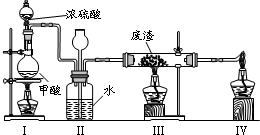
(10分)利用含淀粉的物质可以生产醋酸。下面是生产醋酸的流程,根据流程回答下列问题:
B是日常生活中有特殊香味的常见有机物,在有些饮料中含有B。
(1)写出化学方程式,并注明反应类型:
I、B与醋酸反应: ▲ , ▲ 反应。
II、B→C: ▲ , ▲ 反应。
(2) 可用于检验A的试剂是 ▲ 。
(3)用淀粉[(C6H10O5)n]为原料制取B,若有含淀粉40%的植物果实1kg,经反应制得184g的B,则淀粉的转化率为 ▲ 。(提示:转化率=已反应的量/原有的量×100%)
查看答案和解析>>
科目:高中化学 来源:2010-2011学年湖北省鄂州二中高一(下)期末化学模拟试卷(一)(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com