
 ,下列有关有机物
,下列有关有机物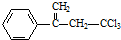 的说法不正确的是( )
的说法不正确的是( )| A. | 属于卤代烃,能使酸性高锰酸钾溶液和溴水褪色 | |
| B. | 该物质存在顺反异构 | |
| C. | 在碱性条件下充分水解,可生成羧酸盐 | |
| D. | 1mol 该物质在一定条件下可与4molH2发生加成反应 |
分析 该有机物中含有苯环和碳碳双键,具有苯和烯烃性质,能发生加成反应、还原反应、氧化反应、加聚反应、取代反应,据此分析解答.
解答 解:A.含有氯原子,属于卤代烃,含有碳碳双键,所以能被酸性高锰酸钾溶液氧化,能和溴发生加成反应,故A正确;
B.该物质中碳碳双键碳原子上有两个H原子,所以没有顺反异构,故B错误;
C.该物质属于氯代烃,在碱性条件下能发生水解反应生成羧基,羧基和碱反应生成盐,故C正确;
D.该分子中苯环和碳碳双键都能和氢气发生加成反应,所以1mol 该物质在一定条件下可与4molH2发生加成反应,故D正确;
故选B.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,易错选项是C,注意同一个碳原子上连接3个卤原子时水解生成羧基.


科目:高中化学 来源: 题型:选择题
| A. | N元素的电负性较大,但N2的化学性质很稳定 | |
| B. | 稀有气体一般难发生反应 | |
| C. | HF比H2O稳定 | |
| D. | HF、HCl、HBr、HI的稳定性逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃101 kPa时,2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1此反应的反应热为221 kJ•mol-1 | |
| B. | 氢气的燃烧热为285.8 kJ•mol-1,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ•mol-1 | |
| C. | 已知2SO2(g)+O2(g)═2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 | |
| D. | 稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1稀硝酸与稀Ba(OH)2溶液反应的中和热为57.3 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学方程式 | K(t1) | K(t2) |
| F2+H2?2HF | 1.8×1036 | 1.9×1032 |
| Cl2+H2?2HCl | 9.7×1012 | 4.2×1011 |
| Br2+H2?2HBr | 5.6×107 | 9.3×106 |
| I2+H2?2HI | 43 | 34 |
| A. | 已知t1>t2,HX的生成反应为放热反应 | |
| B. | 在相同条件下,X2平衡转化率a:F2>Cl2 | |
| C. | X2与H2反应的剧烈程度随着原子序数递增逐渐减弱 | |
| D. | HX的稳定性:HBr>HI |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | H | Li | Be | B | C | O | F |
| X的数值 | 2.20 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 |
| 元素 | Na | Mg | Al | Si | P | S | Cl |
| X的数值 | 0.93 | 1.31 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | M上有气体放出 | |
| B. | M为负极,N为正极 | |
| C. | 化学能转变为电能的装置 | |
| D. | 导线中有电流通过,电流方向由N到M |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是( )
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是( )| A. | 滴入酸性KMnO4溶液振荡,溶液颜色无变化 | |
| B. | 该物质与苯酚属于同系物 | |
| C. | 1mol该物质和H2反应时最多消耗H26 mol | |
| D. | 1mol该物质与浓溴水反应时最多消Br2 4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用如图所示的装置制取乙酸乙酯.
实验室用如图所示的装置制取乙酸乙酯. CH3COOC2H5+H2O,乙酸乙酯的密度比水小(填“大”或“小”),有果香味.
CH3COOC2H5+H2O,乙酸乙酯的密度比水小(填“大”或“小”),有果香味.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
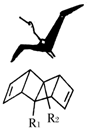 始祖鸟烯形状宛如一只展翅飞翔的鸟,其键线式结构表示如图,其中R1、R2为烷烃基.则下列有关始祖鸟烯的说法中正确的是( )
始祖鸟烯形状宛如一只展翅飞翔的鸟,其键线式结构表示如图,其中R1、R2为烷烃基.则下列有关始祖鸟烯的说法中正确的是( )| A. | 始祖鸟烯与乙烯互为同系物 | |
| B. | 若R1=R2=甲基,则其化学式C12H14 | |
| C. | 若R1=R2=甲基,则始祖鸟烯的一氯代物有3种 | |
| D. | 始祖鸟烯既能使酸性高锰酸钾褪色,也能使溴水褪色,则两反应的反应类型是相同的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com