


科目:高中化学 来源: 题型:
| A、该溶液一定呈酸性 |
| B、该溶液中的c(H+)肯定等于10-3mol/L |
| C、该溶液的pH可能为3,可能为11 |
| D、该溶液一定呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
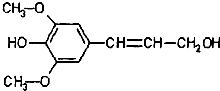
| A、分子式是C11H14O4,属于芳香烃 |
| B、分子中所有碳原子不可能在同一平面 |
| C、不能与Na反应放出H2 |
| D、能发生的反应类型有氧化、取代、加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3molC+1molD |
| B、2molA+2molC |
| C、2molA+1molB+0.5molD |
| D、1molA+0.5molB+1.5molC+0.5molD |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在自来水中加入大量液氯进行消毒 |
| B、加入大量的明矾使浑浊的水变为澄清的水 |
| C、钢铁厂用适量熟石灰[Ca(OH)2]处理酸性废水 |
| D、加入适量S2-处理Hg2+(汞离子)污染的废水 |
查看答案和解析>>
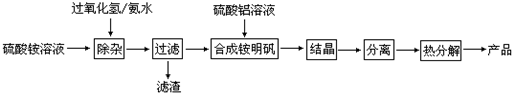
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,0.01mol/L氢氰酸溶液的pH大于2 |
| B、HCN溶液用水稀释后,氢离子浓度下降 |
| C、NaCN溶液呈碱性 |
| D、相同条件下,0.01mol/L氢氰酸溶液的导电性比0.01 mol/L 氯化氢溶液的差 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、施用碳铵(NH4HCO3)后应立即盖上土壤 |
| B、复合肥是两种或两种以上化肥的混合物 |
| C、可用工业用盐作食盐用于烹调 |
| D、三聚氰胺(C3N6H6)俗称“蛋白精”,加入到奶粉中,可提高蛋白质的含量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com