
分析 (1)水溶液中或熔融状态下能够导电的化合物称为电解质,酸、碱、盐都是电解质,电解质导电必须是自身电离;在上述两种情况下都不能导电的化合物称为非电解质,蔗糖、乙醇等都是非电解质,大多数的有机物都是非电解质;单质、混合物既不是电解质也不是非电解质,据此分析即可解答;
(2)置换反应是单质与化合物生成单质与化合物反应;酸碱生成盐和水的反应属于中和反应;酸性氧化物是指能和碱反应生成盐和水的氧化物,酸性氧化物和碱反应生成盐和水.
解答 解:(1)①食盐成分为NaCl,在水溶液里或在熔融状态下,能电离出自由移动的钠离子和氯离子导致导电,所以是电解质;
②酒精是乙醇,是化合物,在水中存在乙醇分子,没有自由移动的离子,故不能导电,是非电解质;
③醋酸水溶液中能够导电,属于电解质;
④Fe 是金属单质,既不是电解质,也不是非电解质;
⑤硫酸的溶液能导电,是电解质;
⑥水几乎不导电,但能电离,属于电解质;
⑦氯气是非单质,既不是电解质,也不是非电解质;
⑧氢氧化钠溶液是氢氧化钠和水的混合物,它既不是电解质也不是非电解质;
⑨二氧化碳在水溶液里,生成碳酸,碳酸能电离出自由移动的氢离子和碳酸根离子导致导电,不是二氧化碳自身电离,所以二氧化碳是非电解质;
⑩蔗糖在水溶液中或熔融状态下只有蔗糖分子,没有自由移动的离子,不导电,是化合物,属于非电解质;
故答案为:①③⑤⑥;②⑨⑩;④⑦⑧;
(2)铁和硫酸能发生置换反应:Fe+H2SO4=FeSO4+H2↑,离子反应为:Fe+2H+=Fe2++H2↑;酸碱中和反应,硫酸和氢氧化钠反应:2NaOH+H2SO4=Na2SO4+2H2O,离子方程式为H++OH-=H2O;酸性氧化物和碱反应生成盐和水,如少量二氧化碳与氢氧化钠反应生成碳酸钠和水,方程式为:CO2+2NaOH=Na2CO3+H2O,
故答案为:Fe+H2SO4=FeSO4+H2↑;Fe+2H+=Fe2++H2↑;2NaOH+H2SO4=Na2SO4+2H2O;H++OH-=H2O;CO2+2NaOH=Na2CO3+H2O.
点评 本题考查了电解质、非电解质判断,化学方程式、离子方程式的书写,明确电解质、非电解质、置换反应、中和反应等概念是解题关键,注意单质、混合物既不是电解质也不是非电解质,题目难度不大.


 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | 电解质与非电解质本质区别是在水溶液或熔化状态下能否电离 | |
| B. | 纯碱、烧碱均属于碱 | |
| C. | 电离时能产生H+的化合物,一定是酸 | |
| D. | 非金属氧化物一定是酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
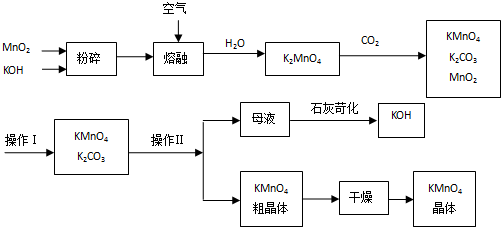
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量 | 0.255g | 0.385g | 0.459g |
| 气体体积 | 280mL | 336mL | 336mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含金属元素的离子不一定都是阳离子 | |
| B. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| C. | 化合物变为单质时,化合价变化的元素一定被还原 | |
| D. | 油锅着火时,立即用水扑灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
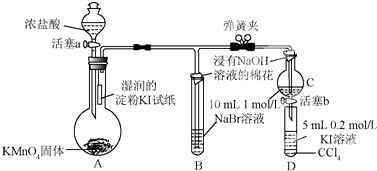
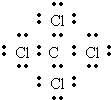 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6L 四氯化碳含有的分子数为0.25NA | |
| B. | 标准状况下,14g 氮气含有的核外电子数为5NA | |
| C. | 标准状况下,22.4L任意比的氢气和氯气的混合气体中含有的分子总数均为NA | |
| D. | 常温常压下,22.4L CO2中含有NA个CO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
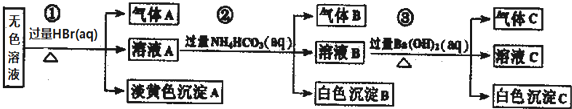
| A. | 根据实验①中的现象可推出,气体A一定是纯净物,淡黄色沉淀一定是AgBr | |
| B. | 根据实验②中的现象可推出,气体B是CO2,沉淀B是Al(OH)3,原溶液中一定含有Al3+ | |
| C. | 根据实验③中的现象可推出,气体C是NH3,沉淀C一定有BaCO3,可能有BaSO4 | |
| D. | 原溶液中肯定含有Na+、AlO2-、S2-,不能确定是否含有SO32-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com