
| A、FeSO4 |
| B、Na2CO3 |
| C、KNO3 |
| D、KCl |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、工业可采用火法炼铜:Cu2S+O2═2Cu+SO2 每生成2mol铜,反应共转移6NA个电子 | ||
| B、P4O6的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则1mol该分子中含有的共价键数目是12NA | ||
| C、一定条件下定容容器中充入3molH2(g)和1mol N2(g)发生反应:3H2(g)+N2(g)?2NH3(g);△H=-QkJ/mol,当该反应放出0.25QkJ的热量时,容器中的氢分子数共有2.25NA | ||
D、标准状况下,定容容器中盛有某气体纯净物,气体密度为ρg?L-1,则该物质相对分子质量为:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol O2和1 mol N2所占的体积都约为22.4 L |
| B、H2的气体摩尔体积约为22.4 L |
| C、在标准状况下,1 mol H2和1 mol H2O所占的体积都约为22.4 L |
| D、在标准状况下,22.4 L由N2、N2O组成的混合气体中所含有的N的物质的量约2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol?L-1的HA溶液的pH约为3[计算公式:PH=-lgC(H+)] |
| B、HA能与水以任意比例互溶 |
| C、HA与盐酸都能与NaOH发生反应 |
| D、甲酸溶液可以导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
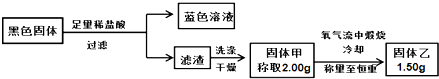
| A、只有CuO |
| B、CuO、Cu2S和CuS |
| C、CuO、CuS |
| D、CuO、Cu2S |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | n(SO2)/mol | n(NO2)/mol |
| 0 | 2.40 | 1.20 |
| 4 | 1.60 | |
| 8 | 0.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由石墨比金刚石稳定可知:C(金刚石,s)═C(石墨,s)△H<0 |
| B、在101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ热量,H2的燃烧热为-285.8 kJ?mol-1 |
| C、在101 kPa时,1 mol C与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ?mol-1 |
| D、在稀溶液中:H+ (aq)+OH- (aq)═H2O(l)△H=-57.31 kJ?mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.31 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
| A、2c1>c3 |
| B、a+b>92.4 |
| C、2p2<p3 |
| D、α1+α3<1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com