
| A. | 漂白粉是混合物,漂粉精是纯净物 | |
| B. | 工业上将氯气通入澄清石灰水制取漂白粉 | |
| C. | 漂白粉的有效成分是Ca(ClO)2 | |
| D. | 漂白液的有效成份是Na2O2 |
分析 漂白粉的有效成分为次氯酸钙,漂白液的有效成分为次氯酸钠,因次氯酸的酸性比碳酸弱,则次氯酸盐在空气中易生成不稳定的次氯酸而导致变质,以此解答该题.
解答 解:A.漂粉精主要成分为氯化钙和次氯酸钙,为混合物,故A错误;
B.因石灰水的浓度较低,工业将氯气通入石灰乳中制取漂白粉,故B错误;
C.工业用石灰乳和氯气反应制备漂白粉,生成氯化钙和次氯酸钙,漂白粉有效成分是次氯酸钙,即Ca(ClO)2,故C正确;
D.漂白液的主要成分是氯化钠和次氯酸钠,有效成分是次氯酸钠,故D错误;
故选C.
点评 本题主要考查了漂白粉的制备、有效成分、化学性质及用途,为高频考点,侧重于基础知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 下列生活用品主要由有机合成材料制成:羊毛衫、腈纶运动衣、涤纶连衣裙、纯棉T恤 | |
| B. | 不锈钢制作就是在普通钢中添加铬、镍等元素改变了钢铁内部结构,所以不锈钢是化合物 | |
| C. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| D. | 建筑业使用大量的沙,常使用内陆河的河沙及海洋的海沙 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | MgCl2 | B. | FeSO4 | C. | Na2SO3 | D. | ZnSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白色固体中既有KI,又有BaCl2 | B. | 白色固体中既有NaBr,又有BaCl2 | ||
| C. | 白色固体中可能有KI | D. | 白色固体中可能没有NaBr |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
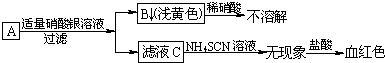
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 0.01mol•L-1的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
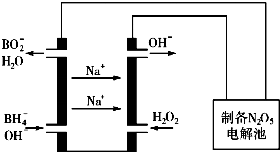
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | T(℃) | NO初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂的比表 面积(m2•g-1) |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | 1.2×10-3 | 124 | ||
| Ⅲ | 350 | 82 |
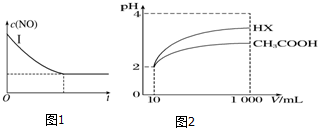
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平 衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 铁的状态 | 盐酸的浓度 | 反应的温度 |
| A | 片状 | 1 mol/L | 20℃ |
| B | 片状 | 3 mol/L | 40℃ |
| C | 粉末 | 1 mol/L | 20℃ |
| D | 粉末 | 3 mol/L | 40℃ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com