
 氢气是新型能源和重要化工原料.
氢气是新型能源和重要化工原料.| 容器编号 | 起始时各物质的物质的量/mol | 平衡时反应中的能量变化 | ||
| H2 | N2 | NH3 | ||
| Ⅰ | 3n | n | 0 | 放出热量a kJ |
| Ⅱ | 3n | 2n | 0 | 放出热量b kJ |
| Ⅲ | 6n | 2n | 0 | 放出热量c kJ |
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | … |
| NH3/mol | 2 | 1.0 | 0.5 | 0.25 | 0.24 | 0.24 |
分析 (1)②-①-③×2得:CH4(g)+CO2(g)=2CO(g)+2H2(g),根据盖斯定律计算反应的焓变;根据化学反应可知,甲烷将二氧化碳转化成有价值的合成气;
(2)①A、实验I和III比较,实验III相当于实验I体积压缩一半,加压时平衡向正方向移动,I、II实验中氢气量相等,氮气量越多,氮气转化率减小,据此回答;
B、根据可逆反应特点,3mol氢气和1mol氮气不能完全生成NH3;
C、根据压强对化学平衡移动的影响来回答;
D、温度不变,平衡常数不变.
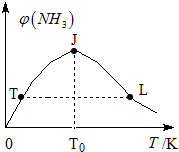
②TJ段未达到平衡,反应向生成氨方向进行,温度升高,反应加快,氨气体积分数增大;当J点达到平衡,JL段:该正反应是放热反应,升高温度,平衡向逆方向移动,促进氨分解,氨的体积分数减小.L点温度高于T点温度,两点的各物质浓度相等;
③根据v=$\frac{△c}{△t}$计算氢气表示的反应速率,根据化学反应中速率之比等于系数之比,v(NH3);
④稀溶液总体积等于两种溶液体积之和,根据电荷守恒计算离子的浓度,根据电离平衡常数表达式计算即可;
(3)氢气直接作燃料电池的负极上的反应是:H2-2e-+2OH-=2H2O,根据能量密度定义计算即可.
解答 解:(1)根据盖斯定律知,②-①-③×2得:CH4(g)+CO2(g)=2CO(g)+2H2(g),所以CH4(g)+CO2(g)=2CO(g)+2H2(g)△H,△H=△H2-△H1-2△H3,这种方法的推广与使用,不仅实现资源综合利用,根据化学反应可知,甲烷将二氧化碳转化成有价值的合成气,还能解决环境问题是减少二氧化碳排放.故答案为:△H2-△H1-2△H3;根据化学反应可知,甲烷将二氧化碳转化成有价值的合成气,减少二氧化碳排放;
(2)①A、实验I和III比较,实验III相当于实验I体积压缩一半,加压时平衡向正方向移动,N2转化率增大,III中氮气转化率大于I中氮气转化率;I、II实验中氢气量相等,氮气量越多,氮气转化率减小,I中氮气转化率大于II中氮气转化率,故III、I、II中氮气转化率依次增大,A错误;
B、可逆反应的热化学方程式表示:1mol氮气和3mol氢气完全反应放出92.4kJ热量.根据可逆反应特点,3mol氢气和1mol氮气不能完全生成NH3.II生成的氨气量大于I,B项正确;
C、如果平衡不移动,III中氨气量是I中2倍,氨气体积分数相等.在恒容条件下,I容器加压变成III,增大压强,平衡向生成NH3方向移动,氨体积分数增大,C正确;
D、温度不变,平衡常数不变,三个容器中平衡常数相等,D错误.
故选BC;
②TJ段未达到平衡,反应向生成氨方向进行,温度升高,反应加快,氨气体积分数增大;当J点达到平衡,JL段:该正反应是放热反应,升高温度,平衡向逆方向移动,促进氨分解,氨的体积分数减小.L点温度高于T点温度,两点的各物质浓度相等,所以,L点氨的正反应速率较大.
故答案为:小于;
③在该条件下,前5分钟氨气平均反应速率为$\frac{\frac{2.0mol-1.0mol}{2L}}{5min}$=0.1mol/(L•min),根据化学反应中速率之比等于系数之比,得出v(H2)=1.5v(NH3)=
=0.15mol/(L•min),故答案为:0.15mol/(L•min);
④稀溶液总体积等于两种溶液体积之和.根据电荷守恒式c(NH4+)+c(H+)=c(OH-)+2c(SO42-),当溶液呈中性时c(H+)=c(OH-),推知:c(NH4+)=2c(SO42-),c(SO42-)=0.5a mol/L,c(NH4+)=a mol/L,c(H+)=c(OH-)=1.0×10-7mol/L,c(NH3•H2O)+c(NH4+)=0.5b mol/L,c(NH3•H2O)=(0.5b-a)mol/L.Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{1{0}^{-7}a}{0.5b-a}$=$\frac{2a}{(b-2a)×107}$,故答案为:$\frac{2a}{(b-2a)×107}$;
(3)H2-2e-+2OH-=2H2O,根据能量密度定义,E=$\frac{\frac{1.2V×\frac{1000g}{2g/mol×2×96500C/mol}}{1kg}}{3.6×1{0}^{6}J•k{W}^{-1}•{h}^{-1}}$=32.2kW•h•kg-1.
故答案为:$\frac{\frac{1.2V×\frac{1000g}{2g/mol×2×96500C/mol}}{1kg}}{3.6×1{0}^{6}J•k{W}^{-1}•{h}^{-1}}$=32.2kW•h•kg-1.
点评 本题综合考查学生化学反应速率的计算、化学平衡移动原理的应用、溶液中离子浓度之间的关系等知识,注意知识的归纳和梳理是解题的关键,难度大.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:解答题
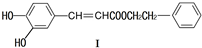 在药物、涂料等领域应用广泛.
在药物、涂料等领域应用广泛.
 ;反应类型:水解(取代)反应
;反应类型:水解(取代)反应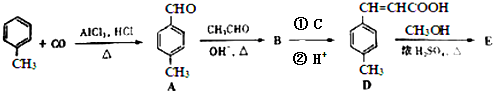
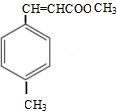 .
.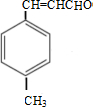 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$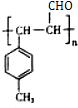 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
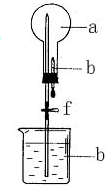 在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b不满足题目要求的是( )
在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b不满足题目要求的是( )| a(干燥气体) | b(液体) | |
| A | NO2 | 水 |
| B | CO2 | 4mol/LNaOH溶液 |
| C | Cl2 | 饱和NaOH溶液 |
| D | NH3 | 1mol/L盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③⑥ | C. | ④⑤⑥ | D. | ①⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18.8g苯酚中含有碳碳双键的个数为0.6NA | |
| B. | 17g羟基(-OH)所含有的电子数是10NA | |
| C. | 标准状况下,11.2L 三氯甲烷所含分子数为0.5NA | |
| D. | 常温常压下,3.0g葡萄糖和冰醋酸的混合物中含有的原子总数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氩气,V正、V逆都增大,且V正增大倍数大于V逆增大倍数 | |
| B. | 加入催化剂,V正、V逆都发生变化,且变化的倍数相同 | |
| C. | 增大压强时,V正、V逆都增大,且V正增大倍数大于V逆增大倍数 | |
| D. | 降低温度时,V正、V逆都减小,且V正减小倍数小于V逆减小倍数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 | |
| B. | 棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O | |
| C. | 植物油和裂化汽油可用溴水鉴别 | |
| D. | 在鸡蛋白溶液中加入浓HNO3,微热后会生成黄色物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某元素基态原子的电子排布图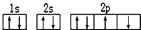 | |
| B. | NH4Cl电子式为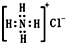 | |
| C. | Ca2+离子基态电子排布式为1s22s22p63s23p6 | |
| D. | 钾(K)的原子结构示意图为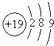 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com